Screening, functional analysis and clinical validation of differentially expressed genes in diabetic foot ulcers
-
摘要:
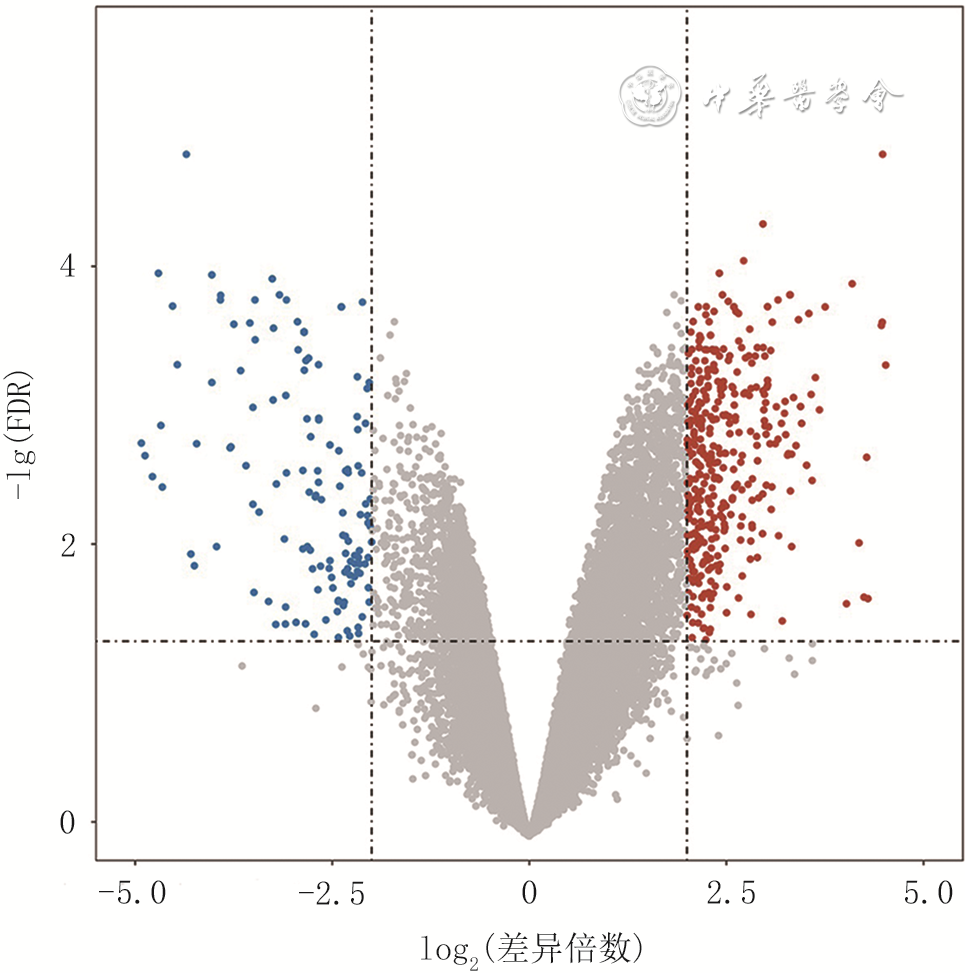
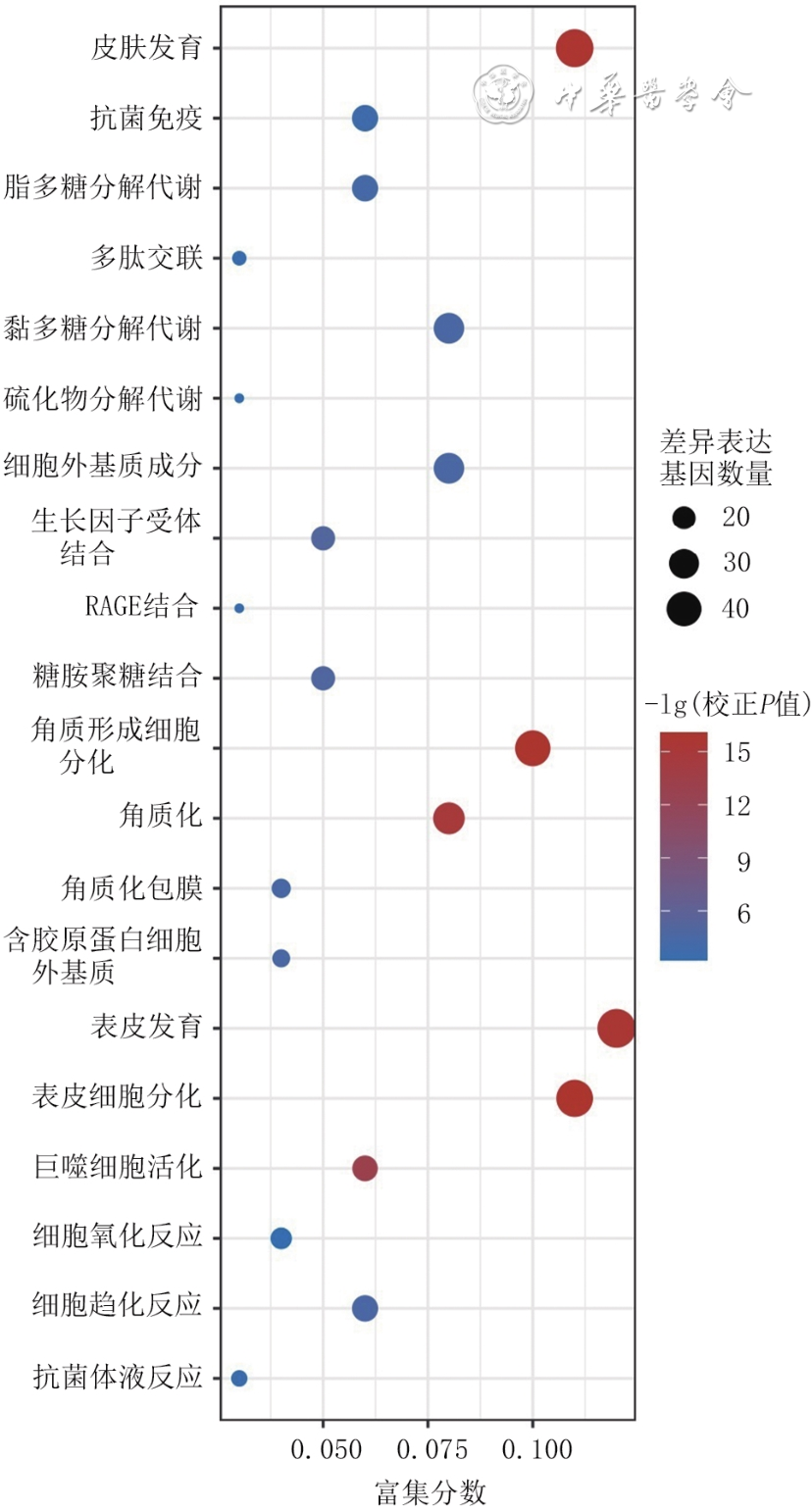
目的 筛选糖尿病足溃疡(DFU)的差异表达基因(DEG)并对其进行功能分析与临床验证,以期为慢性难愈性创面的表观遗传学治疗奠定理论基础。 方法 采用观察性研究方法。选取基因表达综合数据库(GEO)中的DFU患者基因表达谱数据集GSE80178,采用GEO2R工具分析筛选数据集中3个正常皮肤组织样本与6个DFU组织样本之间的DEG。对筛选出的DEG,采用R语言程序包中ClusterProfiler、org.Hs.eg.db、GOplot和ggplot2分别进行生物学过程、分子功能、细胞组分的基因本体论(GO)富集分析和京都基因与基因组百科全书(KEGG)富集分析;采用STRING数据库进行蛋白质-蛋白质相互作用(PPI)分析,筛选DEG中的关键基因,用Cytoscape 3.9.1软件中Cytohubba插件进行关键基因的GO富集分析。取厦门大学附属翔安医院2018年9月—2021年3月收治的15例DFU患者(男7例、女8例,年龄55~87岁)的DFU组织和15例急性创面患者(男6例、女9例,年龄8~52岁)术后弃用的正常皮肤组织,分别采用实时荧光定量反转录PCR法与免疫组织化学法检测富含脯氨酸的小重复蛋白1A(SPRR1A)和晚期角质化包膜蛋白3C(LCE3C)的mRNA与蛋白表达。对数据行独立样本t检验。 结果 与正常皮肤组织比较,从DFU患者DFU组织中筛选出492个差异表达显著的DEG(校正P<0.05或校正P<0.01),包括363个上调DEG和129个下调DEG。GO术语分析显示,DEG在皮肤发育、角质形成细胞(KC)分化、角质化、表皮发育、表皮细胞分化等方面显著富集(校正P值均<0.01);KEGG通路分析显示,DEG在肿瘤相关微小RNA、Ras相关蛋白1信号通路和多能干细胞调控信号通路等方面显著富集(校正P值均<0.01)。PPI分析显示,内披蛋白、SPRR1A、SPRR1B、SPRR2B、SPRR2E、SPRR2F、LCE3C、LCE3E、角蛋白16(均为下调DEG)和丝聚蛋白(为上调DEG)为从DFU患者DFU组织中筛选出的DEG中的关键基因,其显著富集于角质化、KC分化、表皮细胞分化、皮肤发育、表皮发育、多肽交联等GO术语(校正P值均<0.01)。DFU患者DFU组织中SPRR1A和LCE3C的mRNA表达量分别为0.588±0.082与0.659±0.098、蛋白表达量分别为0.22±0.05与0.24±0.04,分别明显低于急性创面患者正常皮肤组织的1.069±0.025与1.053±0.044(t值分别为20.91、13.66,P值均<0.01)、0.38±0.04与0.45±0.05(t值分别为9.69、12.46,P值均<0.01)。 结论 相较于正常皮肤组织,DFU患者DFU组织中存在DEG谱,且DEG显著富集于KC分化及角蛋白功能方面;关键DEG与KC生物学功能相关,在DFU患者DFU组织中的低表达可能阻碍溃疡愈合。 Abstract:Objective To screen the differentially expressed genes (DEGs) in diabetic foot ulcers (DFUs), and to perform functional analysis and clinical validation of them, intending to lay a theoretical foundation for epigenetic therapy of chronic refractory wounds. Methods An observational study was conducted. The gene expression profile dataset GSE80178 of DFU patients in Gene Expression Omnibus (GEO) was selected, and the DEG between three normal skin tissue samples and six DFU tissue samples in the dataset was analyzed and screened using the GEO2R tool. For the screened DEG, ClusterProfiler, org.Hs.eg.db, GOplot, and ggplot2 in the R language packages were used for Gene Ontology (GO) enrichment analysis of biological processes, molecular functions, and cellular components, and Kyoto Encyclopedia of Genes and Genomes (KEGG) enrichment analysis, respectively. Protein-protein interaction (PPI) analysis was performed using STRING database to screen key genes in the DEG, and GO enrichment analysis of key genes was performed using Cytohubba plug-in in Cytoscape 3.9.1 software. DFU tissue and normal skin tissue discarded after surgery were collected respectively from 15 DFU patients (7 males and 8 females, aged 55-87 years) and 15 acute wound patients (6 males and 9 females, aged 8-52 years) who were admitted to Xiang'an Hospital of Xiamen University from September 2018 to March 2021. The mRNA and protein expressions of small proline-rich repeat protein 1A (SPRR1A) and late cornified envelope protein 3C (LCE3C) were detected by real-time fluorescent quantitative reverse transcription polymerase chain reaction and immunohistochemistry, respectively. Data were statistically analyzed with independent sample t test. Results Compared with normal skin tissue, 492 statistically differentially expressed DEGs were screened from DFU tissue of DFU patients (corrected P<0.05 or corrected P<0.01), including 363 up-regulated DEGs and 129 down-regulated DEGs. GO terminology analysis showed that DEGs were significantly enriched in the aspects of skin development, keratinocyte (KC) differentiation, keratinization, epidermal development, and epidermal cell differentiation, etc. (corrected P values all <0.01). KEGG pathway analysis showed that DEGs were significantly enriched in the aspects of tumor-associated microRNA, Ras related protein 1 signaling pathway, and pluripotent stem cell regulatory signaling pathway, etc. (corrected P values all <0.01). PPI analysis showed that endophial protein, SPRR1A, SPRR1B, SPRR2B, SPRR2E, SPRR2F, LCE3C, LCE3E, keratin 16 (all down-regulated DEGs), and filoprotein (up-regulated DEG) were key genes of DEGs screened from DFU tissue of DFU patients, which were significantly enriched in GO terms of keratinization, KC differentiation, epidermal cell differentiation, skin development, epidermis development, and peptide cross-linking, etc. (corrected P values all <0.01). The mRNA expressions of SPRR1A and LCE3C in DFU tissue of DFU patients were 0.588±0.082 and 0.659±0.098, respectively, and the protein expressions were 0.22±0.05 and 0.24±0.04, respectively, which were significantly lower than 1.069±0.025 and 1.053±0.044 (with t values of 20.91 and 13.66, respectively, P values all <0.01) and 0.38±0.04 and 0.45±0.05 (with t values of 9.69 and 12.46, respectively, P values all <0.01) in normal skin tissue of acute wound patients. Conclusions Compared with normal skin tissue, there is DEG profile in DFU tissue of DFU patients, with DEGs being significantly enriched in the aspects of KC differentiation and keratin function. Key DEGs are related to the biological function of KC, and their low expressions in DFU tissue of DFU patients may impede ulcer healing. -
Key words:
- Diabetic foot /
- Ulcer /
- Computational biology /
- Wound repair /
- Healing mechanism /
- Differentially expressed genes
-
(1)设计以外踝上穿支降支逆向供血的外踝上穿支岛状皮瓣,该皮瓣旋转点较传统外踝上穿支皮瓣旋转点下移了7~8 cm,更容易修复足部皮肤软组织缺损创面。
(2)切取皮瓣时,先切开蒂部并暴露出外踝上穿支降支,能有效保护外踝上穿支升支血管,操作难度、手术风险明显降低。
足部皮肤软组织缺损较为常见,主要包括皮肤肿瘤切除后形成的创面、各种外伤所致缺损以及失神经营养造成的足底慢性溃疡等[1, 2, 3]。足背皮下组织少,缺损后极易出现肌腱、骨质外露,需用皮瓣修复;而足底为受压部位,缺损后也需采用皮瓣修复[4, 5, 6, 7, 8]。Masquelet等[9]报道的外踝上皮瓣常被用于修复足部创面,但该皮瓣穿支血管位置较高,旋转半径和转移距离有限,不能修复足部远端创面。本课题组采用以腓动脉外踝上穿支降支为蒂,旋转点位于外踝前下缘的岛状皮瓣修复患者足部皮肤软组织缺损创面,效果良好。
1. 对象与方法
本回顾性观察性研究符合《赫尔辛基宣言》的基本原则。
1.1 入选标准
纳入标准:足部皮肤软组织缺损,采用低位旋转点的外踝上穿支岛状皮瓣修复者。排除标准:随访时间不足2个月者,术中及随访资料不完善者。
1.2 一般资料
兰州大学第二医院2017年10月—2020年8月收治14例符合入选标准的足部皮肤软组织缺损创面患者,其中男6例、女8例,年龄14~77岁,包括足底皮肤肿瘤者4例、足底慢性溃疡者4例、足部交通伤者4例、足部深度烧伤残余创面者2例。肿瘤切除后或清创后创面面积为2.0 cm×2.0 cm~7.0 cm×5.0 cm。
1.3 手术方法
1.3.1 术前穿支定位
术前于患足同侧小腿,标记出外踝尖至腓骨小头连线向胫侧平移2 cm的线(即腓骨前缘体表投影),标记该线与外踝尖上5 cm水平线的交点,用彩色多普勒超声诊断仪于该交点附近寻找外踝上穿支穿出点并标记,沿穿支穿出点向下至外踝前下缘标记出其降支走行、向上标记出其升支走行。
1.3.2 麻醉方式
手术在蛛网膜下腔阻滞麻醉或全身麻醉下进行。
1.3.3 受区准备
在小腿中上1/3处扎驱血带。针对足底皮肤肿瘤,沿病灶边缘扩大2~3 cm,在足底腱膜表面将肿瘤彻底切除,充分止血后,行皮瓣移植修复;对交通伤、慢性溃疡及深度烧伤残余创面彻底清创,清除坏死组织,根据创基感染控制情况及坏死组织清除情况,行皮瓣移植修复或行持续VSD(负压范围-15.96~-7.98 kPa)5~7 d后再行皮瓣移植修复。
1.3.4 皮瓣设计
以外踝尖至腓骨小头连线向胫侧平移2 cm的线为皮瓣轴线,将旋转点设计在外踝前下缘,较传统以外踝上5 cm处的腓动脉前穿支穿出点为旋转点的外踝上穿支皮瓣的旋转点下移7~8 cm。根据创面大小、形状以及距旋转点的距离,设计以外踝上穿支降支为蒂的外踝上穿支岛状皮瓣,皮瓣长、宽均较创面扩大0.5~1.0 cm。于皮瓣旋转点至外踝上穿支穿出点之间设计“S”形切口。
1.3.5 皮瓣切取与转移及供区创面修复
沿皮瓣蒂部“S”形切口设计线自下而上切开皮肤至深筋膜深层,分离出外踝上穿支降支血管束,沿该血管束向下方旋转点位置分离,并注意观察该血管束口径变化情况及周围交通支数量,适当调整旋转点位置,并根据新的旋转点位置重新调整皮瓣位置。沿该血管束向上方逆向探查外踝上穿支血管束穿出位置及其升支进入皮肤位置,该位置需小心分离,保留升支部分周围组织,避免损伤升支血管束。然后沿皮瓣上缘及侧缘小心切开皮肤至深筋膜,注意观察紧贴于深筋膜深面的腓浅神经,保护并剔出腓浅神经,用缝线固定深筋膜与皮肤,防止皮瓣自深筋膜脱离,锐性、钝性结合分离皮瓣至外踝上血管穿出位置,使外踝上穿支升支位于皮瓣内。于外踝上穿支穿出位置离断外踝上穿支并结扎,沿其降支血管束向下方分离至位于外踝前下缘的旋转点,形成以降支逆向供血的岛状皮瓣(本组患者血管蒂长度为8.0~14.0 cm,皮瓣切取面积3.0 cm×2.0 cm~8.0 cm×6.0 cm)。松驱血带,观察皮瓣血运,并彻底止血。于皮瓣旋转点至受区创面近侧浅筋膜层内用组织剪钝性分离出皮下隧道,通过皮下隧道转移皮瓣覆盖创面并缝合固定,皮瓣下放置橡皮引流条或负压引流管。于供区创面检查腓浅神经,并将周围软组织拉拢将其包埋,于大腿外侧取中厚皮片移植修复供区创面,并打包加压包扎。
1.4 术后处理
术后用石膏固定踝关节于功能位,包扎时留观察窗观察皮瓣血运,嘱患者绝对卧床、抬高患肢,静脉输液预防感染,及时更换敷料及拔除引流条或引流管。术后10~12 d皮瓣拆线;供区皮片移植术后8~10 d打开包扎,术后10 d拆线,出院后予抗瘢痕药物及弹力衣压迫治疗,预防瘢痕增生。
1.5 观察指标
观察术后皮瓣成活情况、供受区创面愈合情况及并发症发生情况,随访观察皮瓣及其供区外形、足部功能。
2. 结果
14例患者术后皮瓣均完全成活,供受区创面愈合良好,无血管危象、静脉淤血等发生。随访2~24个月,皮瓣外形较佳、不臃肿、耐磨,穿鞋、行走无影响;供区移植皮片位置略凹陷,无明显瘢痕增生或色素沉着。
典型病例:患者女,51岁,3年前无明显诱因右足底第五跖骨基底处疼痛不适,后形成局部破溃,在外院多次行手术清创、缝合,创面迁延不愈,来兰州大学第二医院就诊。体格检查见右足底第五跖骨基底腓侧1.0 cm×1.0 cm创面,创基晦暗,有少量脓性分泌物;创周皮肤角化,呈黄褐色、质硬。术中将创缘角化的皮肤组织切除,第五跖骨外露,测量创面面积为3.0 cm×2.0 cm。以外踝前下缘为旋转点(旋转点至创面近端距离为10.0 cm),于同侧小腿外侧设计以外踝上穿支降支为蒂、面积为3.5 cm×2.5 cm的低位旋转点的外踝上穿支岛状皮瓣,血管蒂长度为11.0 cm。皮瓣切取后经皮下隧道转移修复创面,取同侧大腿外侧中厚皮片修复皮瓣供区创面。术后皮瓣完全成活,未发生血管危象;术后8 d打开植皮区包扎后见皮片存活良好,术后10 d皮瓣拆线。随访6个月,皮瓣外形较佳,行走功能正常;供区无明显瘢痕增生或色素沉着。见图1。
3. 讨论
外踝上皮瓣[9]自1988年被报道以来已被广泛应用于临床,具有皮瓣血运可靠、质地良好、不牺牲主干血管及解剖简单的优点。传统的外踝上穿支皮瓣一般以外踝上5 cm的腓动脉前穿支穿出点为旋转点,旋转距离受限,难以修复足中部以远创面,且旋转点至足部创面之间的皮肤组织浪费严重,皮瓣的组织利用率低。
低位旋转点的外踝上穿支岛状皮瓣具有以下优势:(1)血供可靠。腓动脉外踝上穿支血管在外踝上5 cm处穿出骨间膜后发出升支、降支,降支于深筋膜下沿腓骨前缘下行,升支穿过深筋膜后发出2条或3条分支,在浅筋膜内上行[10, 11]。低位旋转点的外踝上穿支皮瓣的直接供血来源为升支血管,因此该皮瓣与传统的外踝上皮瓣直接供血血管一致。外踝上穿支血管的降支较升支粗,直至走行至外踝前下缘时口径变化仍不大,且行至外踝远侧时,与跗外侧动脉、跟外侧动脉、跗骨窦动脉及外踝前动脉形成广泛的血管交通网[12, 13, 14, 15],因此逆向供血时血供可靠。(2)血管蒂较长,可修复半径大。外踝上穿支血管降支在外踝以远与外踝前动脉及腓浅神经的营养血管形成纵向血管链[16, 17],因此理论上旋转点最远可达外踝下与第五跖骨基底的中点,该旋转点保证皮瓣可覆盖足部最远端。将本组患者皮瓣旋转点设计在外踝前下缘,不破坏踝关节的血管网,此时旋转点较传统的外踝上穿支皮瓣的旋转点下移7~8 cm,即皮瓣血管蒂长度较传统皮瓣增加7~8 cm,加上升支血管的部分长度,本组病例中血管蒂最长达14.0 cm。(3)较传统的旋转点位于外踝上5 cm的外踝上穿支皮瓣,该皮瓣旋转点低,所以皮瓣切取位置相应更低。外踝上穿支的升支口径明显较其降支小,更像外踝上穿支血管的二级穿支,其在上行途中终末支仅至小腿中段,因此皮瓣超出小腿中段时,超出部分的皮瓣血供不可靠[18]。而将外踝上穿支皮瓣旋转点下移后,能够确保皮瓣位于小腿下段。
本组皮瓣设计与切取的注意事项:(1)先切开蒂部皮肤,暴露出外踝上穿支降支,逆向分离出外踝上穿支穿出点及外踝上穿支升支,最后切开皮瓣。较多文献报道切取皮瓣时,沿皮瓣前侧切开皮肤至深筋膜,并沿深筋膜层向外侧剥离皮瓣,在趾长伸肌与腓骨短肌之间寻找到外踝上穿支[18, 19]。但本研究团队困惑的是,如皮瓣整体位于外踝上穿支穿出点上方,如何寻找穿支穿出点?穿支穿出点距离皮瓣切口较近的情况下,如何确保不会切断外踝上穿支升支?因此,本研究团队对此进行了改良:于外踝上穿支穿出点至外踝前下缘设计“S”形切口,沿此设计线自下而上切开皮肤至深筋膜深层。因外踝前侧及外踝上5 cm内皮下组织少,在此处容易寻找并暴露出外踝上穿支降支,沿降支走行向下解剖至旋转点、向上解剖出外踝上穿支穿出点及其升支,并小心保留该升支于皮瓣内。在向旋转点解剖时,可根据血管口径变化情况及周围交通支多少适当调整旋转点位置,并根据旋转点位置重新调整皮瓣位置,再切取皮瓣。外踝上穿支穿出位置常有变异,特别是术前未进行多普勒定位的情况下,皮瓣位置设计多有不准,而本文中采用的方法是根据皮瓣旋转点及外踝上穿支穿出点的位置设计皮瓣,最大可能做到精确设计,确保皮瓣血运及减少组织浪费。(2)皮瓣切取时注意保护腓浅神经。腓浅神经在外踝上方与该皮瓣轴线一致,应尽量避免损伤该神经而导致小腿外侧与足背感觉功能异常。(3)分离外踝上穿支升支时需保留部分周围组织。部分病例升支血管较细,在分离升支血管时应小心轻柔,不要裸化该血管,需保留周围的皮下组织,避免因该血管痉挛而引发供血障碍。术中观察到1例患者皮瓣松止血带后近40 min血运才得到恢复,因此手术中可准备温盐水,松止血带后可用温盐水对皮瓣及其蒂部进行保温加热。
综上所述,低位旋转点的外踝上穿支岛状皮瓣设计、操作简单,血运可靠,旋转半径大,是修复足部皮肤软组织缺损创面的良好方法。
王鹏:实验操作、数据整理、论文撰写与经费支持;陈昭宏、贾赤宇:研究指导、论文修改、经费支持;蒋丽媛、周小茜:数据整理、数据分析;肖厚安:设计实验、对文章的知识性内容作批评性审阅、获取研究经费、行政与技术及材料支持所有作者均声明不存在利益冲突 -
参考文献
(38) [1] 《多学科合作下糖尿病足防治专家共识(2020版)》编写组.多学科合作下糖尿病足防治专家共识(2020版)精华版(Ⅱ)[J].中华烧伤杂志,2020,36(9):767-785.DOI: 10.3760/cma.j.cn501120-20200217-00062. [2] ArmstrongDG,BoultonAJM,BusSA.Diabetic foot ulcers and their recurrence[J].N Engl J Med,2017,376(24):2367-2375.DOI: 10.1056/NEJMra1615439. [3] JiangY,WangX,XiaL,et al.A cohort study of diabetic patients and diabetic foot ulceration patients in China[J].Wound Repair Regen,2015,23(2):222-230.DOI: 10.1111/wrr.12263. [4] 陈泓邑.生物医学大数据共享中的“信任”与“配享信任”[J].医学与哲学,2021,42(2):23-27.DOI: 10.12014/j.issn.1002-0772.2021.02.05. [5] 姜林宏,张鹤达,钟山亮,等.基于GEO数据库分析circRNAs在胃癌组织中的表达[J].中国肿瘤外科杂志,2020,12(6):529-533.DOI: 10.3969/j.issn.1674-4136.2020.06.008. [6] 张钧栋,杨波,刘霖,等.严重急性呼吸综合征冠状病毒感染肺损伤机制与干预药物的生物信息学分析[J].中华实验和临床病毒学杂志,2020,34(4):367-373.DOI: 10.3760/cma.j.cn112866-20200318-00074. [7] 赵倩倩,尤红俊,肖丹,等.基于基因表达综合数据库芯片的类风湿关节炎生物标志物的筛选与生物信息学分析[J].西安交通大学学报(医学版),2020,41(4):544-552.DOI: 10.7652/jdyxb202004014. [8] 王欣凯,王硕.探究生物信息学的研究进展[J].科技资讯,2020,18(14):228-229.DOI: 10.16661/j.cnki.1672-3791.2020.14.228. [9] 闫小妮,田国祥,郭晓娟,等.GEO数据库架构、申请及数据提取方法与流程[J].中国循证心血管医学杂志,2019,11(2):134-137.DOI: 10.3969/j.issn.1674-4055.2019.02.02. [10] 胡建雄,陈思齐,刘涛,等.R语言在公共卫生领域的应用:基本数据处理[J].华南预防医学,2020,46(2):183-184,188.DOI: 10.12183/j.scjpm.2020.0183. [11] CrosaraKTB,MoffaEB,XiaoY,et al.Merging in-silico and in vitro salivary protein complex partners using the STRING database: a tutorial[J].J Proteomics,2018,171:87-94.DOI: 10.1016/j.jprot.2017.08.002. [12] 江珊,蒋勃,徐桂珍,等.使用Cytoscape对生物网络数据的建模和分析[J].农业网络信息,2017(6):32-37.DOI: 10.3969/j.issn.1672-6251.2017.06.009. [13] 郭光华,朱峰,闵定宏,等.糖尿病足合并难愈性创面外科治疗全国专家共识(2020版)[J/CD].中华损伤与修复杂志:电子版,2020,15(4):256-263.DOI: 10.3877/cma.j.issn.1673-9450.2020.04.005. [14] 申金付,蒋瑞妹,王卓群,等.2型糖尿病患者糖尿病足溃疡复发情况及影响因素[J].中华烧伤杂志,2020,36(10):947-952.DOI: 10.3760/cma.j.cn501120-20190726-00315. [15] DingX,TangQ,XuZ,et al.Challenges and innovations in treating chronic and acute wound infections: from basic science to clinical practice[J/OL].Burns Trauma,2022,10:tkac014[2022-07-31]. https://pubmed.ncbi.nlm.nih.gov/35611318/.DOI: 10.1093/burnst/tkac014. [16] RaghuramAC,YuRP,LoAY,et al.Role of stem cell therapies in treating chronic wounds: a systematic review[J].World J Stem Cells,2020,12(7):659-675.DOI: 10.4252/wjsc.v12.i7.659. [17] WangA,LvG,ChengX,et al.Guidelines on multidisciplinary approaches for the prevention and management of diabetic foot disease (2020 edition)[J/OL].Burns Trauma,2020,8:tkaa017[2022-07-31].https://pubmed.ncbi.nlm.nih.gov/32685563/.DOI: 10.1093/burnst/tkaa017. [18] 马俊,吴霞,宫伟,等.生物信息学相关数据库在肿瘤研究中的应用[J].中国医药生物技术,2019,14(1):69-71.DOI: 10.3969/j.issn.1673-713X.2019.01.014. [19] 林志琥,王君,梁尊鸿,等.干细胞治疗糖尿病足创面的研究进展[J].中华烧伤与创面修复杂志,2022,38(3):281-286.DOI: 10.3760/cma.j.cn501120-20210828-00292. [20] 王雪欣,余鹏,张明谏,等.糖尿病足患者下肢动脉病变和伤口细菌学分析[J].中华烧伤杂志,2018,34(6):386-388.DOI: 10.3760/cma.j.issn.1009-2587.2018.06.014. [21] 薛春利,胡志成,杨祖贤,等.异体脱细胞真皮基质治疗糖尿病足溃疡临床效果荟萃分析[J].中华烧伤杂志,2016,32(12):725-729.DOI: 10.3760/cma.j.issn.1009-2587.2016.12.005. [22] 徐进,殷嫦嫦,宋伟,等.间充质干细胞治疗糖尿病足溃疡的Meta分析[J].中国糖尿病杂志,2019,27(6):417-423.DOI: 10.3969/j.issn.1006-6187.2019.06.004. [23] VerdiJ,ShirianS,SalehM,et al.Mesenchymal stem cells regenerate diabetic foot ulcers: a review article[J].World J Plast Surg,2022,11(1):12-22.DOI: 10.52547/wjps.11.1.12. [24] Álvaro-AfonsoFJ,Sanz-CorbalánI,Lázaro-MartínezJL,et al.Adipose-derived mesenchymal stem cells in the treatment of diabetic foot ulcers: a review of preclinical and clinical studies[J].Angiology,2020,71(9):853-863.DOI: 10.1177/0003319720939467. [25] 任慧雯,王秋月.Epac-Rap1与糖尿病肾病[J].国际内分泌代谢杂志,2015,35(3):170-172.DOI: 10.3760/cma.j.issn.1673-4157.2015.03.007. [26] 陆树良,谢挺,牛轶雯.创面难愈机制研究——糖尿病皮肤的“微环境污染”[J].中华烧伤杂志,2008,24(1):3-5.DOI: 10.3760/cma.j.issn.1009-2587.2008.01.002. [27] 李校堃.坚持梦想 不负韶华:生长因子与创面修复三十年自主创新之路[J].中华烧伤杂志,2020,36(3):161-165.DOI: 10.3760/cma.j.cn501120-20200305-00125. [28] 董叫云,弓家弘,嵇晓芸,等.异体糖尿病大鼠来源脂肪干细胞移植治疗糖尿病大鼠创面的初步评价及其机制探讨[J].中华烧伤杂志,2019,35(9):645-654.DOI: 10.3760/cma.j.issn.1009-2587.2019.09.002. [29] KuritaM,AraokaT,HishidaT,et al.In vivo reprogramming of wound-resident cells generates skin epithelial tissue[J].Nature,2018,561(7722):243-247.DOI: 10.1038/s41586-018-0477-4. [30] RoshanA,MuraiK,FowlerJ,et al.Human keratinocytes have two interconvertible modes of proliferation[J].Nat Cell Biol,2016,18(2):145-156.DOI: 10.1038/ncb3282. [31] PiipponenM,LiD,LandénNX.The immune functions of keratinocytes in skin wound healing[J].Int J Mol Sci,2020,21(22):8790.DOI: 10.3390/ijms21228790. [32] RiouxG,RidhaZ,SimardM,et al.Transcriptome profiling analyses in psoriasis: a dynamic contribution of keratinocytes to the pathogenesis[J].Genes (Basel),2020,11(10):1155.DOI: 10.3390/genes11101155. [33] VermeijWP,BackendorfC.Skin cornification proteins provide global link between ROS detoxification and cell migration during wound healing[J].PLoS One,2010,5(8):e11957.DOI: 10.1371/journal.pone.0011957. [34] MizuguchiY,SpechtS,LunzJG3rd,et al.SPRR2A enhances p53 deacetylation through HDAC1 and down regulates p21 promoter activity[J].BMC Mol Biol,2012,13:20.DOI: 10.1186/1471-2199-13-20. [35] ZhangC,HuZ,LoneAG,et al.Small proline-rich proteins (SPRRs) are epidermally produced antimicrobial proteins that defend the cutaneous barrier by direct bacterial membrane disruption[J].Elife,2022,11:e76729.DOI: 10.7554/eLife.76729. [36] NiehuesH,van der KriekenDA,EderveenTHA,et al.Antimicrobial late cornified envelope proteins: the psoriasis risk factor deletion of LCE3B/C genes affects microbiota composition[J].J Invest Dermatol,2022,142(7):1947-1955.e6.DOI: 10.1016/j.jid.2021.11.036. [37] ZhangX,YinM,ZhangLJ.Keratin 6, 16 and 17-critical barrier alarmin molecules in skin wounds and psoriasis[J].Cells,2019,8(8):807.DOI: 10.3390/cells8080807. [38] 尹丽芬,柳志文,吴昊,等.丝聚蛋白在口腔黏膜下纤维性变中的表达[J].口腔疾病防治,2019,27(9):557-560.DOI: 10.12016/j.issn.2096-1456.2019.09.003. -
-









 下载:
下载:


 下载:
下载: