Changes of heparin-binding protein in severe burn patients during shock stage and its effects on human umbilical vein endothelial cells and neutrophils
-
摘要:
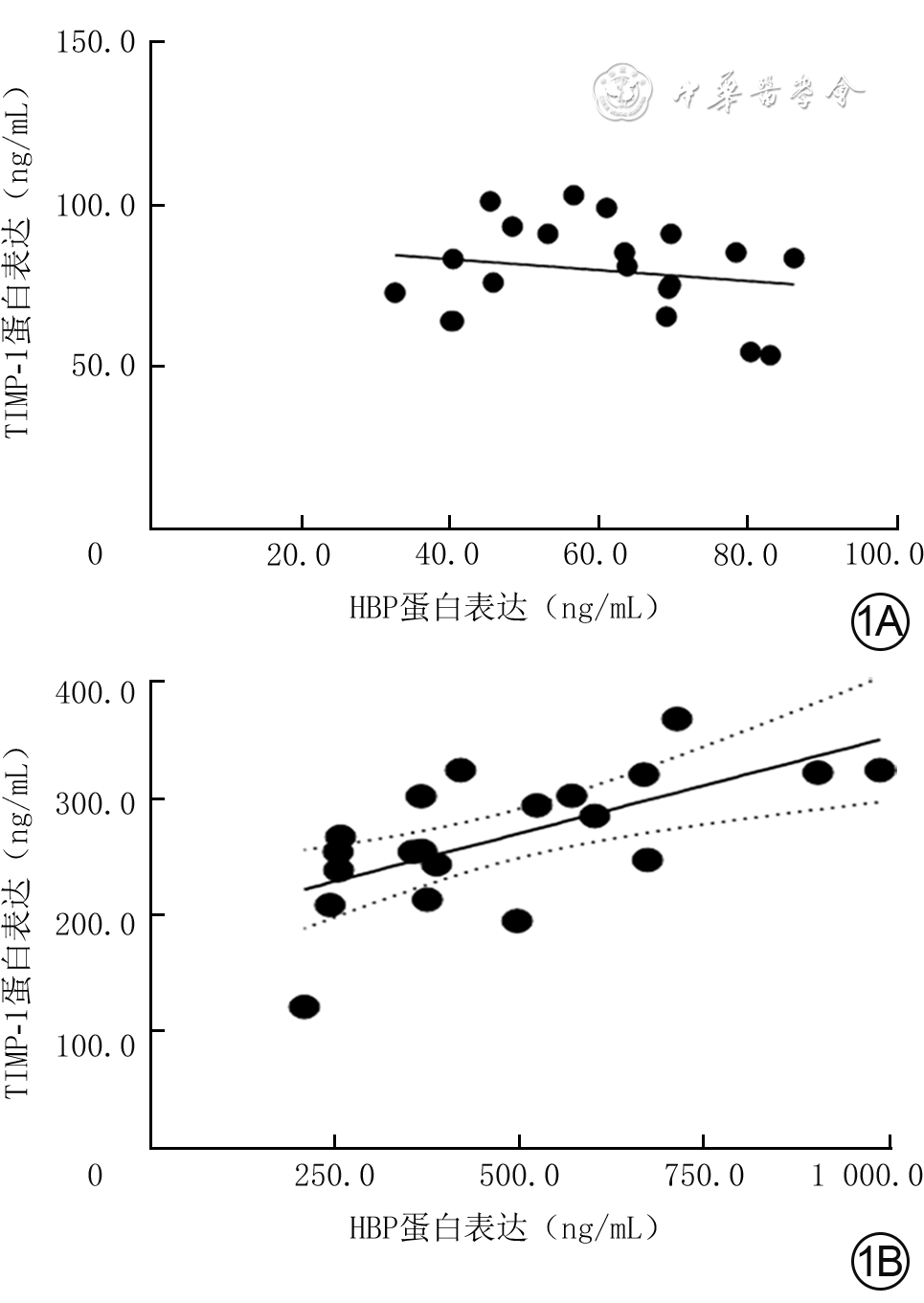
目的 探讨严重烧伤患者休克期肝素结合蛋白(HBP)的变化及其在体外对人脐静脉血管内皮细胞(HUVEC)和中性粒细胞的影响。 方法 采用前瞻性观察性研究与实验研究方法。将2020年8—11月南京医科大学附属苏州医院烧伤整形科收治的符合入选标准的20例严重烧伤患者纳入严重烧伤组[男12例、女8例,年龄为44.5(31.0,58.0)岁],同期招募该单位体检中心体检结果正常的20名健康志愿者纳入健康对照组[男13例、女7例,年龄为39.5(26.0,53.0)岁]。采用酶联免疫吸附测定(ELISA)法检测健康对照组志愿者血浆与严重烧伤组患者伤后48 h内血浆中HBP和组织金属蛋白酶抑制物1(TIMP-1)蛋白表达水平,分别对2组血浆中HBP和TIMP-1蛋白表达的相关性进行Pearson相关分析。取第4代对数生长期HUVEC进行实验,将细胞按随机数字表法(分组方法下同)分为常规培养的正常对照组(处理下同)与进行相应处理的重组HBP(rHBP)处理12 h组、rHBP处理24 h组、rHBP处理48 h组,采用实时荧光定量反转录PCR法检测细胞中TIMP-1的mRNA表达;将细胞分为正常对照组与进行相应处理的rHBP处理48 h组,采用蛋白质印迹法检测细胞中TIMP-1蛋白表达;将细胞分为正常对照组与加入相应试剂处理的单纯rHBP组、单纯抑蛋白酶多肽组、rHBP+抑蛋白酶多肽组(rHBP终物质的量浓度为200 nmol/L,抑蛋白酶多肽终质量浓度为20 μg/mL),培养48 h,采用ELISA法检测细胞培养上清液中TIMP-1蛋白表达水平。采用免疫磁珠分选法从前述10名健康志愿者外周静脉血中分离中性粒细胞,将细胞分为正常对照组与加入相应试剂处理的单纯重组TIMP-1(rTIMP-1)组、单纯佛波酯组、rTIMP-1+佛波酯组(rTIMP-1终质量浓度为500 ng/mL,佛波酯终物质的量浓度为10 nmol/L),培养1 h,采用免疫荧光法观测细胞中CD63蛋白表达,采用流式细胞术检测细胞中CD63蛋白阳性表达率,采用ELISA法检测细胞培养上清液中HBP和髓过氧化物酶(MPO)蛋白表达水平。正常对照组均于适宜时间点进行前述相关检测,细胞实验中各组样本数均为3。对数据行χ2检验、Mann-Whitney U检验、Kruskal-Wallis H检验、Tamhane T2检验。 结果 严重烧伤组患者血浆中HBP、TIMP-1蛋白表达水平分别为404.9(283.1,653.2)、262.1(240.6,317.4)ng/mL,均明显高于健康对照组志愿者的61.6(45.0,68.9)、81.0(66.3,90.0)ng/mL(Z值分别为-5.41、-5.21,P<0.01)。健康对照组志愿者血浆中HBP和TIMP-1蛋白表达相关性不强(P>0.05),严重烧伤组患者血浆中HBP和TIMP-1蛋白表达呈明显正相关(r=0.64,P<0.01)。与正常对照组比较,rHBP处理12 h组、rHBP处理24 h组、rHBP处理48 h组HUVEC中TIMP-1 mRNA表达水平均显著升高(t值分别为-3.58、-2.25、-1.26,P<0.05)。蛋白质印迹法检测显示,与正常对照组比较,rHBP处理48 h组HUVEC中TIMP-1蛋白表达明显增强。培养48 h,与正常对照组比较,单纯rHBP组HUVEC培养上清液中TIMP-1蛋白表达水平显著升高(t=9.43,P<0.05),单纯抑蛋白酶多肽组、rHBP+抑蛋白酶多肽组HUVEC培养上清液中TIMP-1蛋白表达水平均无明显变化(P>0.05);与单纯rHBP组比较,rHBP+抑蛋白酶多肽组HUVEC培养上清液中TIMP-1蛋白表达水平显著下降(t=4.76,P<0.01)。培养1 h,免疫荧光法和流式细胞术检测的各组中性粒细胞CD63蛋白表达结果趋势一致。培养1 h,与正常对照组比较,单纯rTIMP-1组中性粒细胞中CD63蛋白阳性表达率及细胞培养上清液中HBP、MPO蛋白表达水平均无明显变化(P>0.05),单纯佛波酯组、rTIMP-1+佛波酯组中性粒细胞中CD63蛋白阳性表达率及细胞培养上清液中HBP、MPO蛋白表达水平均明显升高(t值分别为2.41、3.82,5.73、1.05、4.16、1.08,P<0.05或P<0.01);与单纯佛波酯组比较,rTIMP-1+佛波酯组中性粒细胞中CD63蛋白阳性表达率及细胞培养上清液中HBP、MPO蛋白表达水平均明显下降(t值分别为5.26、2.83、1.26,P<0.05或P<0.01)。 结论 严重烧伤患者休克期血浆中HBP表达水平增加;HBP可在体外诱导HUVEC分泌TIMP-1,TIMP-1可降低人中性粒细胞CD63分子表达。 Abstract:Objective To investigate the changes of heparin-binding protein (HBP) in severe burn patients during shock stage and its effects on human umbilical vein endothelial cells (HUVECs) and neutrophils in vitro. Methods Prospective observational and experimental research methods were used. Twenty severe burn patients who met the inclusion criteria and were admitted to the Department of Burns and Plastic Surgery of Affiliated Suzhou Hospital of Nanjing Medical University from August to November 2020 were included in severe burn group (12 males and 8 females, aged 44.5 (31.0, 58.0) years). During the same period, 20 healthy volunteers with normal physical examination results in the unit's Physical Examination Center were recruited into healthy control group (13 males and 7 females, aged 39.5 (26.0, 53.0) years). Enzyme-linked immunosorbent assay (ELISA) method was used to detect the protein expression levels of HBP and tissue inhibitor of metalloproteinase 1 (TIMP-1) in plasma of patients within 48 hours after injury in severe burn group and in plasma of volunteers in healthy control group. The correlation between protein expression of HBP and that of TIMP-1 in the plasma in the two groups was analyzed by Pearson correlation analysis. The fourth passage of HUVECs in logarithmic growth phase were used for the experiment. The HUVECs were divided into normal control group with routine culture (the same treatment below) and recombinant HBP (rHBP)-treated 12 h group, rHBP-treated 24 h group, and rHBP-treated 48 h group with corresponding treatment according to the random number table (the same grouping method below), and the mRNA expression of TIMP-1 in cells was detected by real-time fluorescence quantitative reverse transcription polymerase chain reaction. The HUVECs were divided into normal control group and rHBP-treated 48 h group with corresponding treatment, and the protein expression of TIMP-1 in the cells was detected by Western blotting. The HUVECs were divided into normal control group, rHBP alone group, aprotinin alone group, and rHBP+aprotinin group treated with the corresponding reagents (with the final molarity of rHBP being 200 nmol/L and the final concentration of aprotinin being 20 μg/mL, respectively), cultured for 48 h, and ELISA was used to detect the protein expression of TIMP-1 in the culture supernatant of cells. The neutrophils were isolated from the peripheral venous blood of the aforementioned 10 healthy volunteers by immunomagnetic bead sorting, and the cells were divided into normal control group, recombinant TIMP-1 (rTIMP-1) alone group, phorbol acetate (PMA) alone group, and rTIMP-1+PMA group treated with corresponding reagents (with the final concentration of rTIMP-1 being 500 ng/mL and the final molarity of PMA being 10 nmol/L, respectively). After being cultured for 1 h, the expression of CD63 protein in cells was detected by immunofluorescence method, the positive expression rate of CD63 protein in cells was detected by flow cytometry, and the protein expression levels of HBP and myeloperoxidase (MPO) in the culture supernatant of cells were detected by ELISA. The normal control group underwent the above-mentioned related tests at appropriate time points. The number of samples was 3 in each group of cell experiment. Data were statistically analyzed with chi-square test, Mann-Whitney U test, Kruskal-Wallis H test, and Tamhane's T2 test. Results The protein expression levels of HBP and TIMP-1 in the plasma of patients in severe burn group were 404.9 (283.1, 653.2) and 262.1 (240.6, 317.4) ng/mL, respectively, which were both significantly higher than 61.6 (45.0, 68.9) and 81.0 (66.3, 90.0) ng/mL of volunteers in healthy control group (with Z values of -5.41 and -5.21, respectively, P<0.01). The correlation between the protein expression of HBP and that of TIMP-1 in the plasma of volunteers in healthy control group was not strong (P>0.05). The protein expression of HBP was significantly positively correlated with that of TIMP-1 in the plasma of patients in severe burn group (r=0.64, P<0.01). Compared with that in normal control group, the mRNA expression of TIMP-1 in HUVECs was significantly increased in rHBP-treated 12 h group, rHBP-treated 24 h group, and rHBP-treated 48 h group (with t values of -3.58, -2.25, and -1.26, respectively, P<0.05). Western blotting detection showed that compared with that in normal control group, the protein expression of TIMP-1 in HUVECs in rHBP-treated 48 h group was significantly enhanced. After 48 h of culture, compared with that in normal control group, the protein expression level of TIMP-1 in the culture supernatant of HUVECs in rHBP alone group was significantly increased (t=9.43, P<0.05), while the protein expression level of TIMP-1 in the culture supernatant of HUVECs didn't change significantly in aprotinin alone group or rHBP+aprotinin group (P>0.05); compared with that in rHBP alone group, the protein expression level of TIMP-1 in the culture supernatant of HUVECs in rHBP+aprotinin group was significantly decreased (t=4.76, P<0.01). After 1 h of culture, the trend of CD63 protein expression in neutrophils detected by immunofluorescence method and that by flow cytometry were consistent in each group. After 1 h of culture, compared with that in normal control group, the positive expression rate of CD63 protein in the neutrophils and the protein expression levels of HBP and MPO in the culture supernatant of cells in rTIMP-1 alone group all had no significant changes (P>0.05), while the positive expression rate of CD63 protein in the neutrophils and the protein expression levels of HBP and MPO in the culture supernatant of cells were all significantly increased in PMA alone group and rTIMP-1+PMA group (with t values of 2.41, 3.82, 5.73, 1.05, 4.16, and 1.08, respectively, P<0.05 or P<0.01); compared with that in PMA alone group, the positive expression rate of CD63 protein in the neutrophils and the protein expression levels of HBP and MPO in the culture supernatant of cells in rTIMP-1+PMA group were all significantly decreased (with t values of 5.26, 2.83, and 1.26, respectively, P<0.05 or P<0.01). Conclusions The expression level of HBP in the plasma of severe burn patients is increased during shock stage. HBP can induce HUVECs to secrete TIMP-1 in vitro, and TIMP-1 can reduce the expression of CD63 molecule in human neutrophils. -
(1)各种形式的创面修复专科或专科联盟的存在,将在一定程度上对中国特色创面修复学科体系建设起到强力的推动和促进作用。
(2)介绍了近几年出现的几种创面修复专科或区域性创面修复专科联盟建设模式,他们取得的阶段性经验值得大家学习和借鉴。
Highlights:
(1)The existence of various forms of wound repair specialty or consortium to a certain extent plays a key role in promoting the construction of the wound repair discipline system with local conditions in China.
(2)This article introduced several kinds of construction modes of wound repair specialty or regional alliance of wound repair specialty that have emerged in recent years. Their staged successful experience is worth learning and drawing lessons from.
自2019年国家卫生健康委员会批准在全国有条件的医疗机构建立创面修复科以来,中国特色创面修复学科体系建设一直在不断推进和发展,特别是不同地域和不同模式与特色的创面修复专科或专科联盟的建立,对推动当地创面修复学科体系的建设、发展和服务于广大人民群众创面治疗重大需求产生了积极的作用 [ 1] 。近年来,有几家因地制宜、各具特色的创面修复专科或区域性创面修复专科联盟的快速发展和取得的阶段性成果引起了大家的高度重视和关注,其经验值得参考和借鉴。
1. 无锡慢性创面三级防治的“梁溪模式”
2015年左右,我们去江苏无锡参加创面修复培训学术活动,在与吕国忠教授和当时的无锡市梁溪区区长进行交流时,谈到了利用无锡市第三人民医院(现江南大学附属医院)烧伤和创面治疗的学科优势与无锡市社会经济高度发展(属于发达地区)的区位优势,以及创面治疗学科与残疾人联合会和红十字联合会紧密结合的特点,在发达地区建立一个区域性慢性创面防治新模式的设想。之后各项工作被提上了议事日程。2019年,在吕国忠教授带领下,由江南大学附属医院牵头成立无锡市创面修复专科联盟。参与单位主要为无锡市内相关一、二级医疗机构和各社区卫生服务中心及辖区内各养老机构。本着分工合理、服务规范、分级诊疗、双向转诊、急慢分治、有效运转的医疗服务管理机制,使需要进行专科治疗的慢性创面患者获得及时和有效的救治。与此同时,创面修复专科联盟还与民政部门、残疾人联合会、红十字会等成立专项救助基金,将经济困难但具有创面治疗需求的群体作为救助对象进行一体化救治。经过几年的实践,无锡市,特别是梁溪区的创面防治取得了显著成效。与成立专科联盟前相比,主要医疗指标显著改善,包括创面治愈率提高50%左右,创面恶化率下降30%,平均治疗费用下降50%,专科联盟内患者转入率>40%。另外,部分慢性创面治疗项目被列为医保项目,有超过10例贫困患者的创面治疗获得医疗慈善信托基金的资助。
他们取得以上成绩的主要经验包括:(1)完善首诊制度、首接制度、双向转诊制度。创面修复专科联盟协调联盟内医疗机构双向转诊工作,区民政局协调养老院与医疗机构对接等工作,这样使得养老院内部分高龄创面患者能够在医疗机构或者养老院获得有效治疗。(2)确立不同单位的工作职责。牵头单位江南大学附属医院主要承担复杂慢性创面患者的急性期手术治疗,康复医院等联盟内一、二级医院主要承担患者急性期手术后的康复治疗,各社区卫生服务中心和养老机构主要承担一般慢性创面前期防控的宣传教育、创面预防及承接一、二级医院慢性创面稳定期的康复治疗。(3)完善双向转诊流程。明确转出、转入标准。创面修复专科联盟单位之间、各社区卫生服务中心、养老机构分别签订双向转诊协议,建立有效、严密、实用、畅通的上下转诊渠道,为患者提供整体性、连续性的医疗服务。对社区、养老院的患者开通绿色通道,方便转入患者及时获得诊疗服务。同时协助患者选择合适的医院,并提供相关诊疗资料,方便转入医院获得可靠信息,减少重复检查。对慢性创面愈合的患者实行追踪随访、建立档案、预防复发。(4)创新技术保障。依托创面修复技术教育部工程研究中心、国家临床重点专科的临床与教学实力,定期举办创面修复学习班,培养联盟单位的创面修复专家以及各社区卫生服务中心的骨干医务人员,打造出一支以慢性创面专病联盟分级诊疗为亮点的医联体团队。(5)专项救助基金保障。由爱心企业、残疾人联合会、红十字会等成立创面修复专项爱心救助基金。针对困难群体,提出专项爱心救助基金使用申请,解决患者的后顾之忧。(6)建立年度考核机制。创面修复专科联盟牵头单位和参与单位将分级诊疗和双向转诊工作纳入年度综合目标进行考核。
我们把由江南大学附属医院吕国忠教授牵头和无锡市梁溪区建立的这种在一个发达地区开展创面防治的模式称之为“梁溪模式”。这一模式的特点是建立以三级甲等医院创面修复专科为牵引,一、二级医院和各社区卫生服务中心以及养老机构参加的一体化慢性创面防治体系。体系内各级治疗机构分工明确、职责清楚、配合有序。特别是利用发达地区经济实力强劲的区位优势,把地方民政部门、残疾人联合会、红十字会纳入联盟,成立专项爱心救助基金,解决了部分困难群体创面治疗面临的经济问题。这一模式的经验和取得的阶段性成绩值得推广和应用。
2. 皖南创面修复专科联盟形成的“皖南模式”
皖南地区位于安徽省南部,其行政区域包括芜湖、黄山、马鞍山、铜陵、宣城、池州6个市,户籍人口1 907.6万,常住人口约1 809万。一直以来,该地区创面治疗需求大,但在应对上存在以下问题:(1)创面修复医疗资源缺乏。行政区域内6个市级医疗机构中设置了传统的烧伤整形科的仅有7家,但均无创面修复专科,多数医院甚至无专业化创面诊疗门诊或换药门诊。(2)对慢性创面诊治认识不足。三级医院的急慢性创面患者仍然按照传统方式分诊到多个科室进行诊治,县(区)级医院急性创面由骨科和急诊科兼职处理,部分县(区)级医院甚至不愿意或无条件收治各种慢性创面患者。(3)缺乏规范化创面诊治流程。各级医院处理创面以经验化、习惯化为主,缺乏创面规范诊治流程和技术标准,使得区域内各类创面治疗效果差别很大,且因创面处理不当所致并发症发生率高。(4)缺乏不同层面创面修复相关学科之间的交流和合作。不同专业治疗创面存在合作壁垒,使得创面救治“分级诊疗”和“双向转诊”机制难以实现。
2023年,我们在芜湖参加创面修复学科体系建设相关活动时,提出了以皖南医学院弋矶山医院创面修复科牵头,建立区域内与创面修复相关的专科参与的创面修复专科联盟“皖南模式”的设想。其目的是由大医院专业化创面修复专科引领,带动区域内各级医疗机构有序开展创面修复临床诊疗、促进新技术与新方法应用、培养创面修复专业人才、促进学科交叉融合,最终达到提升区域内各种难愈合创面诊疗水平和满足老百姓创面治疗重大需求的目标。
皖南地区创面修复专科联盟创建近1年来取得了较好效果。一是区域内联盟成员单位发展至43家,覆盖皖南地区各市县(区)二级及以上医疗机构,参加科室包括烧伤外科、整形外科、骨科、手足外科等。2023年,专科联盟成员单位中有19家医疗机构先后在原烧伤整形科、骨科或手足外科的基础上,成立相对独立的创面修复科,多数医院手足外科开始在原有创面治疗基础上收治各类创面患者。初步实现了区域内各级医疗机构对创面修复学科的重视和创面患者集中化收治。二是初步实现了创面救治的分级诊疗。联盟内创面患者首诊与常见创面手术、康复和复诊等在基层医疗机构完成,而疑难复杂创面及其手术治疗在三级医院内完成。这种“分级诊疗和双向转诊”就医模式不仅方便患者就医,而且可降低治疗费用。三是联盟内多学科获得同步发展。在促进区域内创面修复学科体系建设和显著提升创面修复学科影响力的同时,也促进了与创面治疗相关的骨科、手足外科、内分泌科、皮肤科、血管外科等多学科的发展。四是取得了显著临床效果。以皖南医学院弋矶山医院创面修复相关学科建设为例,与2022年相比,2023年收治创面患者由992例增加至1 121例,手术台次从1 150台增加至1 321台,科室平均病例组合指数(case mix index,CMI)值从1.767增加至1.959,患者平均住院日从17.85 d下降至13.78 d,平均住院费用从2.803 4万下降至2.528 4万,社会经济效益显著。此外,依托皖南创面修复专科联盟和芜湖市医学会创面修复专委会成立的芜湖市创面修复质量控制小组,为芜湖市内创面修复同质化管理奠定了基础。根据芜湖市医疗保障局2024年1月提供的数据,2023年芜湖市辖区内创面相关疾病患者在省内区域外和外省就诊率<4%。2023年,皖南创面修复专科联盟牵头人丁伟在联盟42家单位中的23家单位完成会诊手术70余次,收治或双向转诊患者115例,这些病例多数为疑难复杂病例。此外,他还通过电话或微信交流,指导基层医院进行常见创面治疗100余例次,开展讲座和学术交流12次,其中2例会诊手术病例获得2023年安徽省行业病例大赛二等奖。
创面修复专科联盟“皖南模式”的特点是:依托大医院创面修复专科牵引和创面修复专家的领衔,通过专科培训、手术示教与基层帮带等方法,带动区域内42家单位创面治疗整体水平的提升,初步实现了创面专科治疗在区域内完成以及治愈率提升和治疗费用下降等效果。
3. 温州创面修复产学研一条龙的“温州模式”
温州创面修复学科建设具有领导重视、区域性产学研结合特色鲜明以及具有强大的创面修复产品研发与转化应用综合实力的特点。2020年1月,在疫情暴发前几天,在温州召开的温州医科大学创面修复学科建设推进会上,我提出了创建创面修复学科“温州模式”的建议。
温州医科大学创面修复学科按照1+1+10+N的模式进行中心化和集群化建设。1个学科中心即创面修复与再生医学中心;1个创面修复专科示范病房;10个核心亚专科,包括手外科、显微外科、烧伤科、内分泌科、整形科、皮肤外科、创伤外科、康复科、中医科、急诊科;N个支撑学科,包括检验科、病理科、超声影像科、介入科、麻醉科、手术室等。目前,创面修复专科示范病区床位达30张,而学科群内总核定床位330张。另外,设置了独立创面修复科专科门诊与创面换药室与康复门诊。
在临床治疗方面,2023年创面修复专科示范病区门诊患者14 147例次,住院患者1 713例,手术2 212例,平均住院日7.71 d,床位使用率95.7%,CMI值2.23。由于创面治疗特色明显,就诊患者辐射到青海、西藏、福建、安徽以及江西等地区。
创面修复与再生医学中心逐渐形成了以细胞因子在创面修复中的机制和应用研究、生物医用功能材料与创面诊治新技术研究、创面愈合的生物力学与修复新技术研究、创面修复微环境调控及干预技术研究等四大科研攻关方向。同时,将组织结构重建与功能再生康复、显微外科修复与器官再造、难愈性创面修复与瘢痕防治、糖尿病足与创面感染治疗作为临床四大诊疗方向。
在学科建设方面,该中心还成功申报中国-中非创面感染与修复专科联合建设项目,成为温州医科大学优势特色学科群建设专项和急危重症诊治与器官再生修复学科群计划项目,创建的肤生工程获“浙江省慈善奖”。2023年1月创建的创面修复科示范病区获批国家重点专科能力建设项目,成为目前国内首个获得的国家重点专科建设项目。在国家临床重点专科建设期间,温州医科大学进一步整合了全国重点实验室与学校和医院等学科资源,谋划建设温州-中国基因药谷-创面修复港。同时把慢性创面防治与人文教育、生物类药物科技攻关与转化、复杂创面修复新技术和新体系的建立以及创面修复与再生医学国际合作紧密结合,为“温州模式”增加新的内容。
4. 解放军总医院解决疑难复杂创面防治和保健难题的“三〇一模式”
2010年左右,我向解放军总医院领导提出了在解放军总医院建立独立的创面修复科的建议。2012年,当时有了建设创面修复科病房的条件,但考虑到生物治疗需要,建立了生物治疗病区,而建立创面修复科就暂缓进行。2014年,我在解放军总医院推进门诊创面治疗机构整合和提升,建立了相对独立的门诊创面治疗中心,进行创面专科治疗探索和创面修复专科人才培养等。2018年,随着军队改革的深入和我的持续建议,解放军总医院终于同意把建设独立的创面修复科列入编制序列。当时领导征求我有关科室取名意见时,我考虑到创面修复与组织再生之间的密切关系以及创建“前店后厂”(前店即创面治疗门诊与病房,后厂即以强大的国家和军队有关组织修复和再生以及创面治疗科学研究为支撑)的新型研究型科室需要,建议采用“组织再生与创面修复科”作为科室名字。2020年12月20日,解放军总医院一个全新的对创面进行专科治疗的科室在第一医学中心正式开诊。
该科室展开床位36张,门诊500余平方米,具有独立的护理单元和科室党支部。到目前为止,在人员编制上,医师和护士已经满足临床诊疗需要。建科3年来,完成全院近5 000张床位术后创面管理和每年20 000例次各类创面换药任务,总计收治患者1 298例次,排前3位的创面依次是医源性创面、慢性骨髓炎创面和糖尿病足创面,分别占30%、22.7%、16.6%,并且90%以上的患者为其他医疗机构治疗无效转入的患者,90%以上的患者来自北京以外的省市。2023年床位使用率为88.3%,创面治愈率100%,平均住院日由2021年的19.12 d下降至2023年的14.53 d。在创面治疗过程中,采用了国际首创的生物三维打印修复新技术以及其他创新和改良的临床手术,在难愈合创面治疗中取得了非常好的效果。
该组织再生与创面修复科的特点如下:一是病房与门诊一体化建设与管理,形成一个完整的科室,解决了以前门诊诊疗、病房患者收治分属于2个部门和医护人员管理不顺畅的问题。二是由于科室定位为解决疑难复杂创面患者治疗难题,尽管总体收治患者人数不多,但难愈合创面患者占比超过90%。三是依托国家和全军创伤修复与组织再生重点实验室强大的科研优势,部分创新治疗技术与产品快速转化应用于临床治疗,不仅解决了研发与应用脱节的问题,同时也使创新技术能够尽快惠及患者,初步实现“前店后厂”的新型研究型科室建设目标。四是体现鲜明的姓军为兵特色,把为部队官兵解决创面治疗难题作为工作的主体,体现了军队科室战斗力作用。五是解决了以往保健对象创面治疗主要以护士换药,没有专科或缺乏专科治疗的不利局面,在干部保健中发挥了重要作用。
5. 总结与展望
总之,自2019年国家卫生健康委员会批准在全国有条件的医院建立创面修复科以来,中国特色创面修复学科体系建设形势喜人,呈现出蓬勃发展、百花齐放之势。有的是新成立的完全独立的创面修复专科,如解放军总医院组织再生与创面修复科、南方科技大学医院创面修复科和瑞金医院创面修复科等 [ 2, 3, 4] ;有的是依托以前烧伤学科优势建立的相对独立的创面修复科(病区),包括陆军军医大学西南医院、海军军医大学长海医院、空军军医大学西京医院、解放军总医院第四医学中心、南昌大学第一附属医院以及江南大学附属医院等;有的是从手足外科转变为创面修复科,有的是在内分泌或糖尿病专科中开展糖尿病足专科治疗,还有的是以创面修复门诊为主体的创面治疗机构。这里需要提及的是,在国家卫生健康委员会批准在全国有条件的医疗机构建立“创面修复科”之前,在上海就开始了创面修复专科建设及其与社区医疗机构双向联动的有益探索,为后期建立各具特色的创面治疗模式提供了借鉴。总之,这些形式多样、各具特色的创面治疗机构对中国特色创面修复学科体系建设起到了显著的推动和促进作用。以上介绍的几种创面修复专科或专科联盟有其自身的特点和阶段性成果可供大家参考,当然也存在一些需要进一步提升的地方。相信随着中国特色创面修复学科体系建设的不断深入和以更高的标准进行规范化、标准化以及体系化建设,中国特色的创面修复学科体系建设会取得更大的成绩 [ 5, 6, 7, 8] 。
戚欣欣、刘璐:实验操作、论文撰写;杨云稀、黄佳敏:数据整理与分析;孙炳伟:研究指导、论文修改、经费支持所有作者均声明不存在利益冲突 -
参考文献
(34) [1] GreenhalghDG. Management of burns[J]. N Engl J Med, 2019, 380(24): 2349-2359. DOI: 10.1056/NEJMra1807442. [2] PavoniV,GianeselloL,PaparellaL,et al.Outcome predictors and quality of life of severe burn patients admitted to intensive care unit[J].Scand J Trauma Resusc Emerg Med,2010,18:24.DOI: 10.1186/1757-7241-18-24. [3] 戚欣欣,杨云稀,孙炳伟.严重烧伤患者早期外周血中性粒细胞趋化功能变化及影响因素[J].中华烧伤杂志,2020,36(3):204-209.DOI: 10.3760/cma.j.cn501120-20190801-00329. [4] ZhangP,ZouB,LiouYC,et al.The pathogenesis and diagnosis of sepsis post burn injury[J/OL].Burns Trauma,2021,9:tkaa047 [2021-12-05].https://academic.oup.com/burnstrauma/article/doi/ 10.1093/burnst/tkaa047/6128653?login=true.DOI:10. 1093/burnst/tkaa047. [5] PerssonBP,HalldorsdottirH,LindbomL,et al.Heparin-binding protein (HBP/CAP37) - a link to endothelin-1 in endotoxemia-induced pulmonary oedema?[J].Acta Anaesthesiol Scand,2014,58(5):549-559.DOI: 10.1111/aas.12301. [6] GierlikowskaB,StachuraA,GierlikowskiW,et al.Phagocytosis, degranulation and extracellular traps release by neutrophils-the current knowledge, pharmacological modulation and future prospects[J].Front Pharmacol,2021,12:666732.DOI: 10.3389/fphar.2021.666732. [7] GautamN,OlofssonAM,HerwaldH,et al.Heparin-binding protein (HBP/CAP37): a missing link in neutrophil-evoked alteration of vascular permeability[J].Nat Med,2001,7(10):1123-1127.DOI: 10.1038/nm1001-1123. [8] YangY,LiuL,GuoZ,et al.Investigation and assessment of neutrophil dysfunction early after severe burn injury[J].Burns,2021,47(8):1851-1862.DOI: 10.1016/j.burns.2021.02.004. [9] LiL,PianY,ChenS,et al.Phenol-soluble modulin α4 mediates Staphylococcus aureus-associated vascular leakage by stimulating heparin-binding protein release from neutrophils[J].Sci Rep,2016,6:29373.DOI: 10.1038/srep29373. [10] VincentZL,MitchellMD,PonnampalamAP.Regulation of TIMP-1 in human placenta and fetal membranes by lipopolysaccharide and demethylating agent 5-aza-2'-deoxycytidine[J].Reprod Biol Endocrinol,2015,13:136.DOI: 10.1186/s12958-015-0132-y. [11] XiaoW,WangL,HowardJ,et al.TIMP-1-mediated chemoresistance via induction of IL-6 in NSCLC[J].Cancers (Basel),2019,11(8):1184.DOI: 10.3390/cancers11081184. [12] JungK.A strong note of caution in using matrix metalloproteinase-1 and its inhibitor, TIMP-1 in serum as biomarkers in systolic heart failure[J].J Intern Med,2008,264(3):291-293.DOI: 10.1111/j.1365-2796.2008.01952.x. [13] JordánA,RoldánV,GarcíaM,et al.Matrix metalloproteinase-1 and its inhibitor, TIMP-1, in systolic heart failure: relation to functional data and prognosis[J].J Intern Med,2007,262(3):385-392.DOI: 10.1111/j.1365-2796.2007.01823.x. [14] JayasankarV,WooYJ,BishLT,et al.Inhibition of matrix metalloproteinase activity by TIMP-1 gene transfer effectively treats ischemic cardiomyopathy[J].Circulation,2004,110(11 Suppl 1):SII180-186.DOI: 10.1161/01.CIR.0000138946.29375.49. [15] MarchesiC,DentaliF,NicoliniE,et al.Plasma levels of matrix metalloproteinases and their inhibitors in hypertension: a systematic review and meta-analysis[J].J Hypertens,2012,30(1):3-16.DOI: 10.1097/HJH.0b013e32834d249a. [16] WürtzSO,SchrohlAS,MouridsenH,et al.TIMP-1 as a tumor marker in breast cancer--an update[J].Acta Oncol,2008,47(4):580-590.DOI: 10.1080/02841860802022976. [17] LambertE,DasséE,HayeB,et al.TIMPs as multifacial proteins[J].Crit Rev Oncol Hematol,2004,49(3):187-198.DOI: 10.1016/j.critrevonc.2003.09.008. [18] JungKK,LiuXW,ChircoR,et al.Identification of CD63 as a tissue inhibitor of metalloproteinase-1 interacting cell surface protein[J].EMBO J,2006,25(17):3934-3942.DOI: 10.1038/sj.emboj.7601281. [19] OrbanC. Diagnostic criteria for sepsis in burns patients[J]. Chirurgia(Bucur),2012,107(6):697-700. [20] WhiteCE,RenzEM.Advances in surgical care: management of severe burn injury[J].Crit Care Med,2008,36(7 Suppl):S318-324.DOI: 10.1097/CCM.0b013e31817e2d64. [21] BlindermanC,LapidO,ShakedG.Abdominal compartment syndrome in a burn patient[J].Isr Med Assoc J,2002,4(10):833-834. [22] 宋明明,刘璐,戚欣欣,等.肝素结合蛋白增加烧伤早期血管通透性的机制研究[J].中华危重病急救医学,2020,32(3):330-335.DOI: 10.3760/cma.j.cn121430-20200123-00248. [23] PeetersY,VanderveldenS,WiseR,et al.An overview on fluid resuscitation and resuscitation endpoints in burns: past, present and future. Part 1 - historical background, resuscitation fluid and adjunctive treatment[J].Anaesthesiol Intensive Ther,2015,47 Spec No:s6-14.DOI: 10.5603/AIT.a2015.0063. [24] PeetersY,LebeerM,WiseR,et al.An overview on fluid resuscitation and resuscitation endpoints in burns: past, present and future. Part 2 - avoiding complications by using the right endpoints with a new personalized protocolized approach[J].Anaesthesiol Intensive Ther,2015,47 Spec No:s15-26.DOI: 10.5603/AIT.a2015.0064. [25] 黄跃生.严重烧伤脏器损害综合防治的思考[J].中华烧伤杂志,2020,36(8):647-650.DOI: 10.3760/cma.j.cn501120-20200521-00278. [26] MufsonMA.Pneumococcal pneumonia[J].Curr Infect Dis Rep,1999,1(1):57-64.DOI: 10.1007/s11908-999-0011-9. [27] ConteMS,DesaiTA,WuB,et al.Pro-resolving lipid mediators in vascular disease[J].J Clin Invest,2018,128(9):3727-3735.DOI: 10.1172/JCI97947. [28] MikelisCM,SimaanM,AndoK,et al.RhoA and ROCK mediate histamine-induced vascular leakage and anaphylactic shock[J].Nat Commun,2015,6:6725.DOI: 10.1038/ncomms7725. [29] LiuL,ShaoY,ZhangY,et al.Neutrophil-derived heparin binding protein triggers vascular leakage and synergizes with myeloperoxidase at the early stage of severe burns (with video)[J/OL].Burns Trauma,2021,9:tkab030[2021-12-05].https://pubmed.ncbi.nlm.nih.gov/34646891/.DOI: 10.1093/burnst/tkab030. [30] 何兴凤,伍国胜,罗鹏飞,等.脓毒症血管通透性分子调控机制研究进展[J].中华烧伤杂志,2020,36(10):982-986.DOI: 10.3760/cma.j.cn501120-20190724-00308. [31] SchmidtEP,YangY,JanssenWJ,et al.The pulmonary endothelial glycocalyx regulates neutrophil adhesion and lung injury during experimental sepsis[J].Nat Med,2012,18(8):1217-1223.DOI: 10.1038/nm.2843. [32] PagenstecherA,StalderAK,KincaidCL,et al.Regulation of matrix metalloproteinases and their inhibitor genes in lipopolysaccharide-induced endotoxemia in mice[J].Am J Pathol,2000,157(1):197-210.DOI: 10.1016/S0002-9440(10)64531-2. [33] CowlandJB,BorregaardN.Granulopoiesis and granules of human neutrophils[J].Immunol Rev,2016,273(1):11-28.DOI: 10.1111/imr.12440. [34] FisherJ,LinderA.Heparin-binding protein: a key player in the pathophysiology of organ dysfunction in sepsis[J].J Intern Med,2017,281(6):562-574.DOI: 10.1111/joim.12604. -
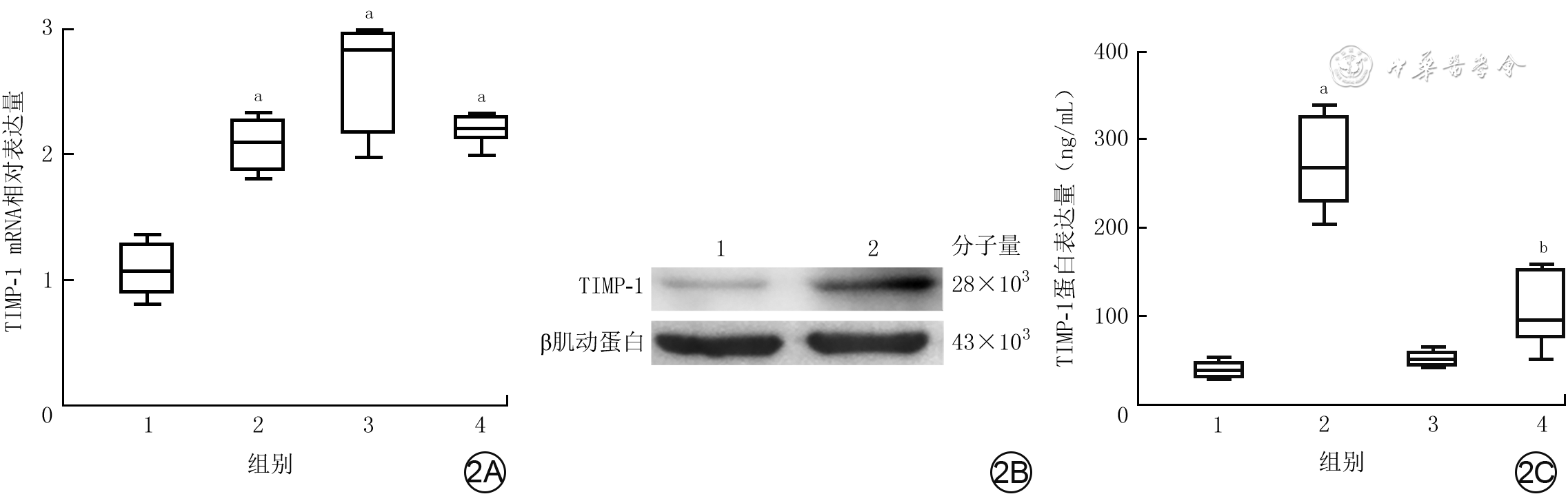
2 3种分组处理后人脐静脉血管内皮细胞的TIMP-1的mRNA和蛋白表达。2A.4组细胞中TIMP-1 mRNA表达箱式图[样本数为3,M(Q1,Q3)];2B.蛋白质印迹法检测的2组细胞中TIMP-1蛋白表达条带图;2C.培养48 h后4组细胞培养上清液中TIMP-1蛋白表达箱式图[样本数为3,M(Q1,Q3)]
注:TIMP-1为组织金属蛋白酶抑制物1;图2A中横坐标1、2、3、4分别为正常对照组(于适宜时间点检测,后同)、重组肝素结合蛋白(rHBP)处理12 h组、rHBP处理24 h组、rHBP处理48 h组;与正常对照组比较,aP<0.01;图2B中1、2分别为正常对照组、rHBP处理48 h组;图2C中横坐标1、2、3、4分别为正常对照组、单纯rHBP组、单纯抑蛋白酶多肽组、rHBP+抑蛋白酶多肽组,与正常对照组比较,aP<0.05;与单纯rHBP组比较,bP<0.01
3 4组从健康志愿者外周静脉血分离的中性粒细胞培养1 h后CD63蛋白表达 异硫氰酸荧光素-4',6-二脒基-2-苯基吲哚×630,图中标尺为10 μm。3A、3B、3C.分别为正常对照组(于适宜时间点检测)CD63染色、细胞核染色、CD63与细胞核染色重叠图片,细胞核完整,CD63蛋白表达较多;3D、3E、3F.分别为单纯重组组织金属蛋白酶抑制物1(rTIMP-1)组CD63染色、细胞核染色、CD63与细胞核染色重叠图片,细胞核完整,图3D中CD63蛋白表达与图3A相近;3G、3H、3I.分别为单纯佛波酯组CD63染色、细胞核染色、CD63与细胞核染色重叠图片,细胞核完整,图3G中CD63蛋白表达明显多于图3A;3J、3K、3L.分别为rTIMP-1+佛波酯组CD63染色、细胞核染色、CD63与细胞核染色重叠图片,细胞核完整,图3J中CD63蛋白表达明显多于图3A但明显少于图3G
注:CD63阳性染色为黄绿色,细胞核阳性染色为蓝色
4 4组从健康志愿者外周静脉血分离的中性粒细胞培养1 h后细胞的CD63、HBP和MPO蛋白表达。4A.细胞中CD63蛋白阳性表达率流式直方图;4B.细胞培养上清液中HBP蛋白表达箱式图[样本数为3,M(Q1,Q3)];4C.细胞培养上清液中MPO蛋白表达箱式图[样本数为3,M(Q1,Q3)]
注:rTIMP-1为重组组织金属蛋白酶抑制物1,HBP为肝素结合蛋白,MPO为髓过氧化物酶;图4B、4C横坐标中1、2、3、4分别为正常对照组(于适宜时间点检测)、单纯rTIMP-1组、单纯佛波酯组、rTIMP-1+佛波酯组;图4B中,与正常对照组比较,aP<0.01;与单纯佛波酯组比较,bP<0.05;图4C中,与正常对照组比较,aP<0.01,bP<0.05;与单纯佛波酯组比较,cP<0.05
表1 严重烧伤组患者与健康对照组志愿者一般资料比较
组别 例数/人数 性别(例) 年龄[岁,M(Q1,Q3)] 平均动脉压[mmHg,M(Q1,Q3)] 中性粒细胞计数 [×109/L,M(Q1,Q3)] 男 女 严重烧伤组 20 12 8 44.5(31.0,58.0) 92.8(85.1,100.5) 17.70(12.16,23.24) 健康对照组 20 13 7 39.5(26.0,53.0) 87.1(74.8,99.4) 7.35(6.48,8.21) 统计量值 χ2=0.11 Z=-0.21 Z=-0.66 Z=-3.17 P值 0.744 0.827 0.513 0.034 注:1 mmHg=0.133 kPa -









 下载:
下载:
 下载:
下载: