Investigation on the growth factor regulatory network of dermal fibroblasts in mouse full-thickness skin defect wounds based on single-cell RNA sequencing
-
摘要:
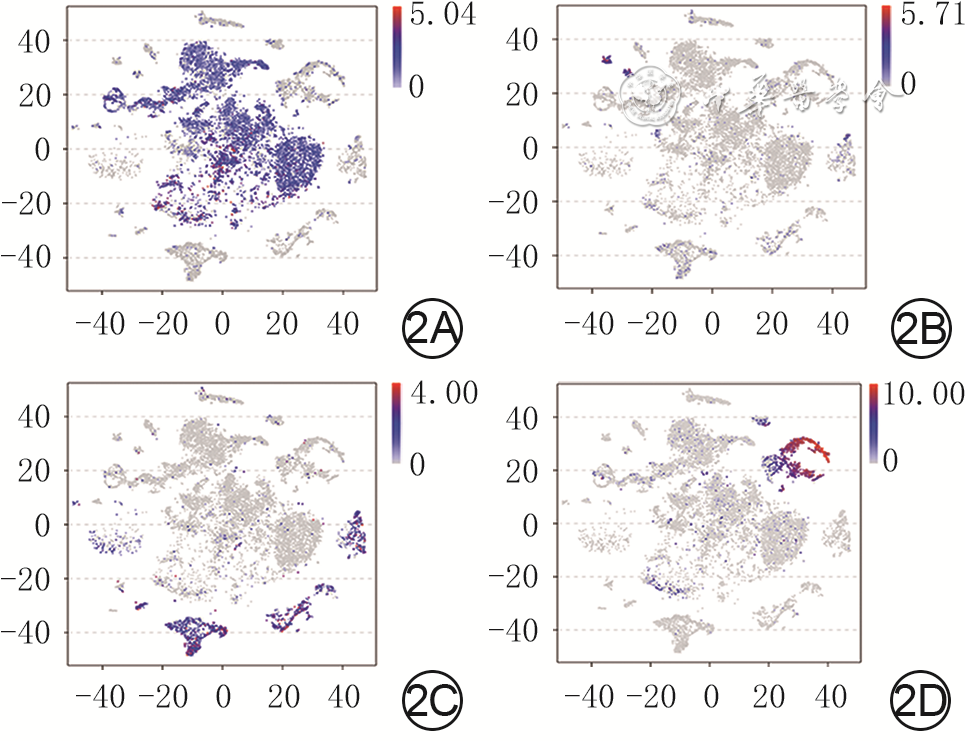
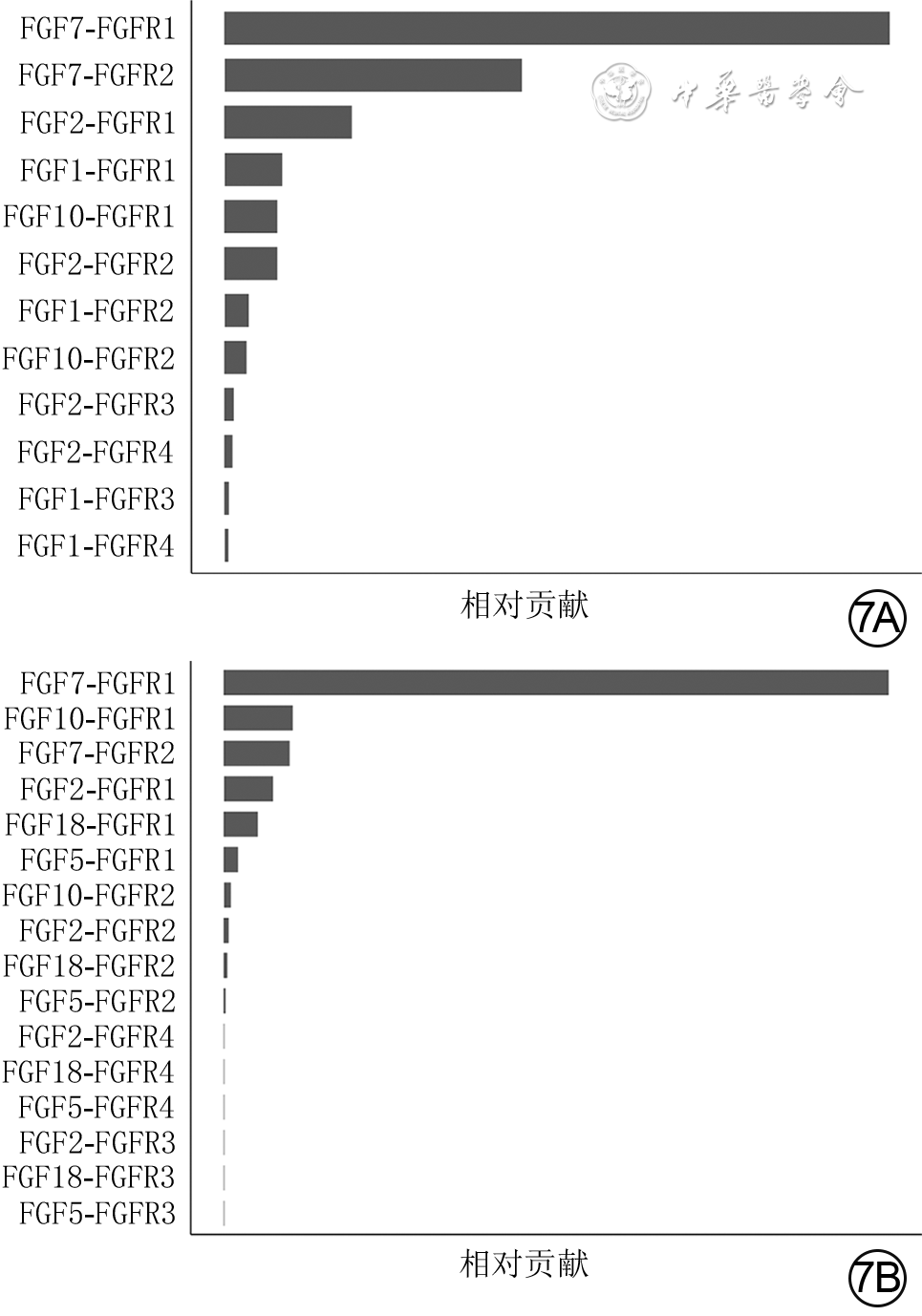
目的 基于单细胞RNA测序探讨小鼠全层皮肤缺损创面中真皮成纤维细胞(dFb)的异质性与生长因子调控网络。 方法 采用实验研究方法。取5只8周龄雄性健康C57BL/6小鼠(鼠龄、性别、品系下同)正常皮肤组织,另取5只背部全层皮肤缺损小鼠伤后7 d创面组织,用胶原酶D和DNA酶Ⅰ消化组织获得细胞悬液,用10x Genomics平台构建测序文库,用Illumina Novaseq6000测序仪进行单细胞RNA测序。采用R4.1.1软件的Seurat 3.0程序分析获得2种组织细胞的基因表达矩阵,采用按细胞群、细胞来源、标记皮肤中主要细胞基因分类的二维tSNE云图进行可视化展示。根据已有文献报道和CellMarker数据库检索情况,分析2种组织细胞的基因表达矩阵中标志基因表达情况,对各细胞群进行编号和定义。将基因表达矩阵和细胞分群信息导入R4.1.1软件的CellChat 1.1.3程序,分析2种组织中细胞间通信以及创面组织血管内皮生长因子(VEGF)、血小板衍生生长因子(PDGF)、表皮生长因子(EGF)、成纤维细胞生长因子(FGF)信号通路中的细胞间通信,2种组织中FGF的各亚型与FGF受体(FGFR)各亚型的两两配对(以下简称FGF配受体对)对FGF信号网络的相对贡献,2种组织中相对贡献排名前2的FGF配受体对信号通路中的细胞间通信。取1只健康小鼠正常皮肤组织和1只全层皮肤缺损小鼠伤后7 d创面组织,行多重免疫荧光染色,检测FGF7蛋白的表达与分布及其与二肽基肽酶4(DPP4)、干细胞抗原1(SCA1)、平滑肌肌动蛋白(SMA)和PDGF受体α(PDGFRα)的蛋白共定位表达。 结果 健康小鼠正常皮肤组织和全层皮肤缺损小鼠伤后7 d创面组织中均包含25个细胞群,但2种组织中各细胞群中细胞数不一致。PDGFRα、血小板内皮细胞黏附分子1、淋巴管内皮透明质酸受体1、受体型蛋白酪氨酸磷酸酶C、角蛋白10和角蛋白79基因在二维tSNE云图上均有各自明确的分布,分别指示特定的细胞群。将25个细胞群按C0~C24编号,分为9个dFb亚群和16个非dFb群,dFb亚群包括C0间质祖细胞、C5脂肪前体细胞、C13具有收缩能力的肌肉细胞相关成纤维细胞等,非dFb群包括C3中性粒细胞、C8 T细胞、C18红细胞等。与健康小鼠正常皮肤组织比较,全层皮肤缺损小鼠伤后7 d创面组织中细胞间通信更多更密集,其中细胞间通信强度排前3位的细胞群为dFb亚群C0、C1、C2,这3个dFb亚群与创面组织中其他细胞群之间均有通信。在全层皮肤缺损小鼠伤后7 d创面组织中,VEGF信号主要由dFb亚群C0发送、脉管相关细胞群C19和C21接收,PDGF信号主要由周细胞C14发送、多个dFb亚群接收,EGF信号主要由角质形成细胞亚群C9和C11发送、dFb亚群C0接收,FGF信号的主要发送者和接收者均为dFb亚群C6。健康小鼠正常皮肤组织和全层皮肤缺损小鼠伤后7 d创面组织FGF信号网络中的FGF配受体对相对贡献,均是FGF7-FGFR1排在首位,排名第2的分别是FGF7-FGFR2、FGF10-FGFR1;与正常皮肤组织比较,创面组织FGF7-FGFR1信号通路中的细胞间通信更多,而FGF7-FGFR2和FGF10-FGFR1信号通路中的细胞间通信稍有减少或无明显变化;创面组织FGF7-FGFR1信号通路中的细胞间通信强于FGF7-FGFR2、FGF10-FGFR1信号通路;在2种组织中,FGF7信号均主要由dFb亚群C0与C1和C2发送、dFb亚群C6和C7接收。与健康小鼠正常皮肤组织比较,全层皮肤缺损小鼠伤后7 d创面组织中FGF7蛋白表达更多;在正常皮肤组织中,FGF7蛋白主要表达于皮肤间质层且在靠近真皮白色脂肪组织附近也有表达;在2种组织中,FGF7蛋白与DPP4、SCA1蛋白共定位表达于皮肤间质层中,与PDGFRα蛋白共定位表达于dFb中,与SMA蛋白无共定位表达,其中创面组织中的共定位表达多于正常皮肤组织。 结论 小鼠全层皮肤缺损创面愈合过程中的dFb存在高异质性,为多种生长因子潜在的主要分泌或接收细胞群落,与生长因子信号通路之间存在紧密、复杂的联系;FGF7-FGFR1信号通路是创面愈合过程中的主要FGF信号通路,靶向调控多个dFb亚群。 Abstract:Objective To explore the heterogeneity and growth factor regulatory network of dermal fibroblasts (dFbs) in mouse full-thickness skin defect wounds based on single-cell RNA sequencing. Methods The experimental research methods were adopted. The normal skin tissue from 5 healthy 8-week-old male C57BL/6 mice (the same mouse age, sex, and strain below) was harvested, and the wound tissue of another 5 mice with full-thickness skin defect on the back was harvested on post injury day (PID) 7. The cell suspension was obtained by digesting the tissue with collagenase D and DNase Ⅰ, sequencing library was constructed using 10x Genomics platform, and single-cell RNA sequencing was performed by Illumina Novaseq6000 sequencer. The gene expression matrices of cells in the two kinds of tissue were obtained by analysis of Seurat 3.0 program of software R4.1.1, and two-dimensional tSNE plots classified by cell group, cell source, and gene labeling of major cells in skin were used for visual display. According to the existing literature and the CellMarker database searching, the expression of marker genes in the gene expression matrices of cells in the two kinds of tissue was analyzed, and each cell group was numbered and defined. The gene expression matrices and cell clustering information were introduced into CellChat 1.1.3 program of software R4.1.1 to analyze the intercellular communication in the two kinds of tissue and the intercellular communication involving vascular endothelial growth factor (VEGF), platelet-derived growth factor (PDGF), epidermal growth factor (EGF), and fibroblast growth factor (FGF) signal pathways in the wound tissue, the relative contribution of each pair of FGF subtypes and FGF receptor (FGFR) subtypes (hereinafter referred to as FGF ligand receptor pairs) to FGF signal network in the two kinds of tissue, and the intercellular communication in the signal pathway of FGF ligand receptor pairs with the top 2 relative contributions in the two kinds of tissue. The normal skin tissue from one healthy mouse was harvested, and the wound tissue of one mouse with full-thickness skin defect on the back was harvested on PID 7. The multiple immunofluorescence staining was performed to detect the expression and distribution of FGF7 protein and its co-localized expression with dipeptidyl peptidase 4 (DPP4), stem cell antigen 1 (SCA1), smooth muscle actin (SMA), and PDGF receptor α (PDGFRα) protein. Results Both the normal skin tissue of healthy mice and the wound tissue of full-thickness skin defected mice on PID 7 contained 25 cell groups, but the numbers of cells in each cell group between the two kinds of tissue were different. Genes PDGFRα, platelet endothelial cell adhesion molecule 1, lymphatic endothelial hyaluronic acid receptor 1, receptor protein tyrosine phosphatase C, keratin 10, and keratin 79 all had distinct distributions on two-dimensional tSNE plots, indicating specific cell groups respectively. The 25 cell groups were numbered by C0-C24 and divided into 9 dFb subgroups and 16 non-dFb groups. dFb subgroups included C0 as interstitial progenitor cells, C5 as adipose precursor cells, and C13 as contractile muscle cells related fibroblasts, etc. Non-dFb group included C3 as neutrophils, C8 as T cells, and C18 as erythrocytes, etc. Compared with that of the normal skin tissue of healthy mice, the intercellular communication in the wound tissue of full-thickness skin defected mice on PID 7 was more and denser, and the top 3 cell groups in intercellular communication intensity were dFb subgroups C0, C1, and C2, of which all communicated with other cell groups in the wound tissue. In the wound tissue of full-thickness skin defected mice on PID 7, VEGF signals were mainly sent by the dFb subgroup C0 and received by vascular related cell groups C19 and C21, PDGF signals were mainly sent by peripheral cells C14 and received by multiple dFb subgroups, EGF signals were mainly sent by keratinocyte subgroups C9 and C11 and received by the dFb subgroup C0, and the main sender and receiver of FGF signals were the dFb subgroup C6. In the relative contribution rank of FGF ligand receptor pairs to FGF signal network in the normal skin tissue of healthy mice and the wound tissue of full-thickness skin defected mice on PID 7, FGF7-FGFR1 was the top 1, and FGF7-FGFR2 or FGF10-FGFR1 was in the second place, respectively; compared with those in the normal skin tissue, there was more intercellular communication in FGF7-FGFR1 signal pathway, while the intercellular communication in FGF7-FGFR2 and FGF10-FGFR1 signal pathways decreased slightly or did not change significantly in the wound tissue; the intercellular communication in FGF7-FGFR1 signal pathway in the wound tissue was stronger than that in FGF7-FGFR2 or FGF10-FGFR1 signal pathway; in the two kinds of tissue, FGF7 signal was mainly sent by dFb subgroups C0, C1, and C2, and received by dFb subgroups C6 and C7. Compared with that in the normal skin tissue of healthy mouse, the expression of FGF7 protein was higher in the wound tissue of full-thickness skin defected mouse on PID 7; in the normal skin tissue, FGF7 protein was mainly expressed in the skin interstitium and also expressed in the white adipose tissue near the dermis layer; in the two kinds of tissue, FGF7 protein was co-localized with DPP4 and SCA1 proteins and expressed in the skin interstitium, co-localized with PDGFRα protein and expressed in dFbs, but was not co-localized with SMA protein, with more co-localized expression of FGF7 in the wound tissue than that in the normal skin tissue. Conclusions In the process of wound healing of mouse full-thickness skin defect wound, dFbs are highly heterogeneous, act as potential major secretory or receiving cell populations of a variety of growth factors, and have a close and complex relationship with the growth factor signal pathways. FGF7-FGFR1 signal pathway is the main FGF signal pathway in the process of wound healing, which targets and regulates multiple dFb subgroups. -
Key words:
- Wound healing /
- Skin /
- Dermis /
- Fibroblasts /
- Fibroblast growth factors /
- Single-cell RNA sequencing /
- Growth factor /
- Intercellular communication
-
如何准确高效地预测烧伤患者的预后一直是烧伤学科密切关注的问题,早在20世纪60年代,就有学者建立了Baux评分以预测烧伤患者病死率,随后又出现了许多国际上较广泛认可的预测模型,如Ryan评分、简明烧伤严重程度指数(ABSI)等,为烧伤患者预后评估提供了更多选择。21世纪以来,烧伤预后相关预测模型更是得到了学术界的密切关注,许多学者在原有模型基础上进行改良完善,提出了更多相对简便、更为精准的预测模型。近几十年来,随着重症监护技术及临床救治手段的不断完善,烧伤患者的救治成功率也在不断提升,但降低烧伤患者病死率仍是临床工作中的一项重要任务,烧伤预后相关预测模型能够对患者的预后进行早期评估,对为烧伤患者制订更为科学的救治方案有积极帮助。因此,熟悉预测模型的优点不足及其适用性,对于临床救治工作而言具有重要意义。本文主要讨论烧伤患者预后相关预测模型的发展,并对其中一些预测模型及相关危险因素加以论述,旨在为临床工作中对烧伤患者的预后评估提供思路。
1. 烧伤患者预后相关预测模型的简要发展史
烧伤预后相关预测模型是指应用烧伤患者基本信息、体征、血清学指标等建立的用于预测患者病死率、评估预后的指数或评分公式。早在1961年就有学者根据烧伤患者年龄和烧伤程度之和来预测病死率,也就是在20世纪广泛应用的Baux评分 [ 1] ;1982年Tobiasen等 [ 2] 考虑到年龄及烧伤面积以外的影响因素,提出了ABSI;1998年,Ryan等 [ 3] 通过引入3种危险因素,创立了Ryan评分。
进入21世纪后,各种预测模型更是层出不穷,并不断得以改良。2005年,Moreau等 [ 4] 通过引入年龄、烧伤总面积、出院后生存时间,并将年龄标准化,建立了针对烧伤患者的年龄风险评分。2008年,Gomez等 [ 5] 提出了包含年龄、急性生理学和慢性健康状况评价Ⅱ(APACHEⅡ)、烧伤面积及性别在内的火焰评分,该评分在APACHEⅡ基础上进一步改良,尤其适用于危重症烧伤患者。2009年,比利时烧伤研究组根据烧伤患者的年龄、烧伤面积和是否合并吸入性损伤制订了比利时烧伤预后(BOBI)评分 [ 6] 。2010年Osler等 [ 7] 提出了改良Baux评分,现BOBI、改良Baux评分均在欧美国家得到了较广泛认可。
继改良Baux评分后,更多学者投入到烧伤患者预后相关预测模型的研究中。2012年Davis等 [ 8] 通过引入年龄、烧伤总面积、改良创伤评分制订了适用于预测老年烧伤患者死亡风险的预测模型。2013年,澳大利亚学者开发了烧伤评估和病死率研究模型用于预测烧伤ICU(BICU)患者的死亡情况,并把女性作为十分重要的危险因素 [ 9] 。2014年,因原损伤严重程度评分对烧伤患者的预测效能较低,有学者将年龄及烧伤总面积添加至评分中,得到了准确性更高的烧伤特异性损伤严重程度评分 [ 10] 。同样在2014年,英国学者综合年龄、烧伤面积、吸入性损伤、致伤因素及并发症等危险因素建立了适用于英国烧伤患者的死亡预测模型 [ 11] 。Taylor等 [ 12] 也根据美国烧伤协会国家烧伤资源库2000—2009年的患者数据,将年龄进行分层计算,并引入吸入性损伤和烧伤面积,从而建立了适用于各个年龄段烧伤患者的死亡风险预测模型。2016年,我国学者综合烧伤患者入院特征(性别、年龄、烧伤总面积、Ⅲ度烧伤面积、是否合并吸入性损伤、休克情况等)开发了预测烧伤病死率的数学模型 [ 13] 。2019年,韩国学者综合考虑年龄、烧伤面积、吸入性损伤、血清乳酸、pH值、凝血酶原时间等10个变量,建立了用于反映烧伤死亡风险和疾病严重程度的汉江模型 [ 14] 。2020年,我国学者在改良SIRS评分的基础上建立了用于评估大面积烧伤患者死亡风险的联合预测模型,其指标包括年龄、改良SIRS评分和Ⅲ度烧伤面积,但并未在临床上得到应用 [ 15] 。同样在2020年,我国学者在BOBI、Ryan、改良Baux评分及ABSI的基础上提出了用于预测烧伤患者病死率的新模型 [ 16] ,但该模型也尚未在临床上得到应用。2020年5月,Bartels等 [ 17] 将ABSI中性别因素剔除,并制订新的年龄量表,得到改良ABSI。2020年9月我国学者引入呼吸机使用情况、连续性肾脏替代治疗、烧伤指数这3个指标,建立了特重度烧伤患者死亡风险列线图预测模型 [ 18] ,但该模型未被应用于临床。2021年,日本学者同样对ABSI进行了修改,提出了用于预测烧伤合并吸入性损伤患者院内病死率的改良ABSI [ 19] 。2023年,德国学者在评估了7 276例烧伤患者后提出了烧伤病死率预测评分,评估指标除年龄、烧伤面积外还包括烧伤并发症(2种以上)、致伤原因(工伤、交通事故、自杀等)等 [ 20] ,但其适用性在我国尚未得到证实。
2. 国内外一些烧伤患者预后相关预测模型的进展
可用于烧伤患者预后评估的预测模型数量不少,但只有少数得到较广泛认可。20世纪比较被认可的烧伤患者预后相关预测模型主要为Baux评分和ABSI,目前比较实用、新颖的预测模型包括火焰、Ryan、改良Baux评分及BOBI评分、APACHEⅡ等,我国学者自21世纪以来也提出了数个预测模型,但均未被进一步推广使用。下面本文将对国内外一些可能较有应用前景的预测模型作进一步汇总分析。
2.1 ABSI及改良ABSI
相对于Baux评分,ABSI准确性更高,预测指标主要包括年龄(1~5分)、性别(女性记1分、男性记0分)、烧伤总面积(1~10分)、Ⅲ度烧伤(有记1分、无记0分)、合并吸入性损伤(1分)等 [ 21] 。ABSI总得分≤7分,烧伤患者的生存率可达90%以上;总得分为8、9分,生存率在50%~70%;总得分为10、11分,生存率则只有20%~40%;总得分≥12分,生存率低至10%以下,救治希望渺茫 [ 22] 。此预测模型在国际上得到了许多学者的认可,在临床上使用较广泛,在预测烧伤患者病死率方面有比较不错的准确性。在本研究团队看来,虽然ABSI充分考虑到了性别、Ⅲ度烧伤及吸入性损伤对预后的影响,但吸入性损伤及Ⅲ度烧伤所占比重过小,且未对年龄进行分层考虑,相较于目前较为广泛认可的预测模型而言,准确性较低。Bartels等 [ 17] 在分析了2015—2018年德国烧伤登记在册的14 984例患者的数据后重新评估了ABSI中的变量,将性别因素去除,并对年龄因素进行重新评估;日本学者同样对ABSI进行修改,在原基础上引入是否行机械通气这一预测因子,得到改良ABSI,该模型对烧伤合并吸入性损伤患者院内病死率预测准确性较高 [ 19] 。以上2个学者团队虽然均改良了ABSI,但2种改良ABSI的可靠性均尚未得到国际认可。
2.2 Ryan评分
Ryan等 [ 3] 对1 665例急性烧伤患者进行了回顾性分析,并使用logistic回归分析得出Ryan评分,其主要包括3个危险因素,即患者年龄≥60岁、烧伤总面积≥40%TBSA及合并吸入性损伤。根据危险因素个数,患者病死率可分为4个等级,当无危险因素时,病死率仅为0.3%;存在1个危险因素时,病死率为3%;存在2个危险因素时,病死率为33%;同时拥有3个危险因素时,病死率则达到90% [ 1] 。Ryan评分虽比较简便,但是准确性并不算高,对各个年龄段和烧伤面积的针对性较差,在评估老年患者时也只是将≥60岁作为风险因素 [ 23] 。另Ryan评分还忽略了小儿患者、Ⅲ度烧伤面积等因素。目前,Ryan评分未在我国得到应用。
2.3 APACHEⅡ与火焰评分
APACHE最初在20世纪80年代初由Knaus等 [ 24] 开发。随着APACHE的发展,1985年更新为APACHEⅡ,由最初的34个变量减少至12个,1991年又更新为APACHEⅢ [ 1] 。对于烧伤患者而言,APACHEⅡ更具价值。APACHEⅡ常被用于评估重症患者,其评分指标范围较广,包括年龄、慢性健康评分、格拉斯哥昏迷评分、生命体征及血清学指标(动脉血pH值、钠钾离子浓度、血肌酐、血细胞比容及白细胞计数);资料提示,APACHEⅡ>8分时烧伤患者的死亡风险为轻度危险;>15分时为中度危险;>20分时则为重度危险,且患者病死率极高,可达到80%~100%,APACHEⅡ得分越高,提示烧伤患者的预后越差 [ 25] 。APACHEⅡ虽不是专用于烧伤患者,但其与脓毒症相关性器官功能衰竭评价类似,可以准确评估全身器官损伤的严重程度,帮助预测烧伤患者最终病死率 [ 26] 。针对烧伤患者,后期又有学者提出了火焰评分,火焰评分=-8.285+0.045×年龄(岁)+0.157×APACHEⅡ得分+0.062×Ⅱ度烧伤面积(%TBSA)+0.104×Ⅲ度烧伤面积(%TBSA)-1.214(男性患者),最终病死率=e^(火焰评分)÷{1+e^(火焰评分)}。此评分在原APACHEⅡ基础上进行了改良,对烧伤患者病死率的预测准确性更高,尤其适用于危重症烧伤患者,在BICU的烧伤患者病死率统计上,其准确性甚至高于改良Baux、BOBI评分等 [ 27] 。火焰评分的预测指标虽然综合考虑了年龄、性别、烧伤面积等方面,但未将吸入性损伤考虑在内;且APACHEⅡ与火焰评分计算过程均过于烦琐,临床上实施起来比较困难。
2.4 BOBI评分
2009年,比利时烧伤研究小组分析了1999—2003年5 246例烧伤患者的数据,开发了BOBI评分,其中年龄层面:<50岁得0分,50~64岁得1分,65~79岁得2分,>80岁得3分;烧伤面积层面:<20%TBSA得0分,20%~39%TBSA得1分,40%~59%TBSA得2分,60%~79%TBSA得3分,>80%TBSA得4分;吸入性损伤层面:合并吸入性损伤得3分,无吸入性损伤则得0分;BOBI评分0~10分对应的患者病死率分别为0.1%、1.5%、5%、10%、20%、30%、50%、75%、85%、95%、99% [ 6] 。BOBI评分因准确性较高、计算相对简便,在欧洲一些发达国家中广泛应用,尤其适用于老年患者。但其不足也比较明显,相对其他预测模型而言过于机械、灵活性较差,在年龄层面还忽略了小儿群体;在吸入性损伤方面,也只是简单地根据有和无来分类,并没有作进一步划分;在计算烧伤面积时,也未将面积根据不同烧伤深度分开计算,而是将Ⅱ、Ⅲ度烧伤面积混合计算。因而,相对其他预测模型而言,BOBI评分的准确率并不算高。
2.5 改良Baux评分
因原Baux评分不包含吸入性损伤的影响,Osler等 [ 7] 添加了是否合并吸入性损伤这个危险因素,并使用logistic回归模型对39 888例烧伤患者进行校准,最终得到的公式如下:改良Baux分数=年龄(岁)+烧伤总面积(%TBSA)+(17×I);其中患者若合并吸入性损伤,则I=1、否则I=0。改良Baux得分越高表示烧伤患者死亡风险越高,改良Baux分数>130分时常提示预后不良,死亡风险高。这种方法不仅计算简便,而且预测准确性高,在美国等发达国家得到了广泛应用 [ 28] 。但作为公认的预测模型,改良Baux评分并不算完美,其对小儿烧伤患者的适用性较差,Lam和Minh [ 29] 表示,改良Baux评分仅在合并吸入性损伤的老年烧伤患者病死率预测中可靠性较高,在成年烧伤群体中准确性亦可接受,但在儿童烧伤群体中价值较低,有必要进一步建立针对烧伤患儿的预测模型。有学者认为,因儿童和老人体质上的特殊性,改良Baux评分预测结果“一刀切”的模式并不能准确反映老年和儿童烧伤患者的结局,因此主张将儿童、青年、老人分开评估 [ 12] 。2013年伊朗学者通过分析870例烧伤患儿后开发了适用于儿童患者的儿科-Baux评分,其认为烧伤患儿年龄<15岁时,年龄越大,病死率越低 [ 30] 。此外,改良Baux评分在烧伤面积的计算中并没有充分考虑Ⅲ度烧伤面积的比重。因此,改良Baux评分可能需在年龄、烧伤面积及吸入性损伤层面作进一步改进,以获得更加准确的评估效果。
2.6 联合预测模型
联合预测模型由海军军医大学第一附属医院全军烧伤研究所提出,其具体预测公式如下:Ln[P÷(1-P)]=-7.322+0.912×改良SIRS评分+0.035×Ⅲ度烧伤面积(%TBSA)+0.062×年龄(岁),其Ln是以常数e为底数的对数,P代表病死率 [ 15] ,P值越高代表预后越差。该模型充分考量了年龄、改良SIRS评分和Ⅲ度烧伤面积等危险因素,其中SIRS评分包含了吸入性损伤及气管切开等重要危险因素,并将吸入性损伤分级,不足是未能将年龄进行分层计算。其准确性与改良Baux评分相当,但从临床适用性上来说,该模型比改良Baux评分更适用于危重症患者。目前,联合预测模型缺乏在临床广泛应用的多中心数据。
2.7 关于Logit(P)指数的新模型
有关Logit(P)指数的新模型由我国学者回顾性分析5 006例烧伤患者后提出(并用4 619例烧伤患者进行了外部验证)。具体公式如下:Logit(P)=In[P÷(1-P)]=-7.91+0.7×性别(男性=1、女性=0)+吸入性损伤(轻度=0.6、中度/重度=1.2)+年龄(0~5岁/40~59岁=0.8、60~79岁=2.4、≥80岁=4.0)+0.48×烧伤总面积(每10%体表总面积)+0.24×Ⅲ度烧伤面积(每10%体表总面积) [ 16] ,其中P代表患者病死率,P值越高提示预后越差。该预测模式综合考虑了年龄、性别、吸入性损伤、Ⅲ度烧伤面积等因素,并对年龄和吸入性损伤进行了分层考量,把不同年龄段及不同程度的吸入性损伤对烧伤预后的影响均考虑在内,且计算也较简便。但遗憾的是该预测模式尚未在临床广泛推广,其准确性及临床适用性有待进一步论证。
3. 相关危险因素分析
虽然每种预测模型的侧重点均不同,但从近十几年我国烧伤患者的救治过程中可以得出,我国大部分烧伤死亡患者具有“高龄、烧伤面积>50%TBSA、Ⅲ度烧伤面积占比大、合并吸入性损伤”等特征 [ 31, 32, 33, 34] 。因此,高效准确的预测模型不仅要计算简便,还要能综合考虑年龄、性别、烧伤总面积、Ⅲ度烧伤面积、吸入性损伤和内脏并发症等危险因素。
烧伤患者涵盖了中青年、老人、儿童在内的所有人群,因此,对于烧伤预后的评估不能一概而论,尤其是遭遇大面积烧伤时,这3种群体的耐受程度大相径庭。女性因耐受力较弱,在发生特重烧伤后病死率要高于男性 [ 35] 。儿童各项器官功能尚未成熟,老年患者各项器官功能已经开始衰弱,对烧伤打击的耐受力均不及健康中青年。除了年龄因素外,烧伤面积也是影响预后的关键因素,尤其是Ⅲ度烧伤面积,更是造成烧伤患者死亡的主要危险因素。来自阿尔巴尼亚的一份统计和分析数据显示,烧伤深度和烧伤原因等危险因素决定了特重烧伤患者最终的结局,贯穿皮肤全层的烧伤和合并吸入性损伤均可使患者的致死风险增加4倍 [ 36] 。因此,Ⅲ度烧伤面积在评估预后中应占据更为重要的地位。
造成烧伤患者死亡风险升高的重要危险因素还包括吸入性损伤和内脏并发症,在过去的几十年里,烧伤合并吸入性损伤在我国的发病率和病死率虽在逐渐下降,但其仍是烧伤致命的危险因素之一 [ 18] 。本研究团队认为,吸入性损伤不能简简单单地以“有或无”来划分,轻度与重度吸入性损伤对肺脏造成的损伤全然不同。轻度吸入性损伤只累及支气管层面,对肺实质并无太大的损伤;而重度吸入性损伤却累及肺泡层面,并常伴有大范围的炭末沉积、痰液渗出及严重的炎症反应 [ 37] 。造成烧伤患者死亡的另一重要原因为内脏并发症,现如今,其已经成了烧伤患者公认的死因。尤其在发生严重的心力衰竭和/或肾衰竭时,常预示着病情已进展至终末阶段。Brandão等 [ 38] 观察到在烧伤入院评分中引入并发症,可以更好地预测烧伤患者病死率,并推荐了一种对慢性合并症进行评分的标准化方法:Charlson合并症指数,其可以准确预测患者1年内的病死率。内脏并发症常见于心、肺、肾等重要脏器,其中,以肺脏并发症发生率最高,其发生率与吸入性损伤息息相关。2022年北京积水潭医院烧伤科专家团队分析显示,在223例严重烧伤患者中,有162例并发吸入性损伤,其中有近20例患者死亡 [ 34] 。除了肺外,心、肾并发症亦是造成患者死亡的重要因素;我国学者通过回顾性分析252例重度烧伤患者资料了解到并发心肌损害者死亡风险比未并发心肌损害者高得多 [ 39] 。我国学者在637例重度烧伤患者中观察到严重烧伤后急性肾损伤仍然很普遍 [ 40] ,与重度烧伤患者的高病死率息息相关。
4. 展望
自21世纪以来,烧伤面积、年龄、吸入性损伤及内脏并发症等已经成为烧伤患者死亡的公认危险因素,内脏并发症虽是大部分烧伤患者最终死因,但血清学指标作为预测内容的适用性有待进一步研究。许多学者提出的预测模型亦是围绕这些危险因素来开展的,尤其是改良Baux评分,更是得到了国际的较广泛认可。但本研究团队认为,由我国学者提出的烧伤患者预后相关预测模型可能更符合我国烧伤患者的特点,希望临床上对这些模型可以有更多的外部验证以证实其可靠性和临床实用性。
孙礼祥:实验操作、数据整理、论文撰写、经费支持;吴帅:数据处理与论文撰写;张小薇:实验操作;刘文杰:论文修改;张凌娟:研究指导、论文修改、经费支持所有作者均声明不存在利益冲突调节性T细胞(Treg)可以通过多种机制来减轻炎症反应和防止自身免疫反应。常驻在外周组织(即非淋巴组织)的Treg有特异性的功能,比如,皮肤组织中的Treg可以促进创面愈合、抑制真皮纤维化、促进表皮再生和增强毛囊生长周期。皮肤组织中的Treg可通过促进影响上皮细胞生物学功能的整合素和TGF-β途径基因的表达,在转录水平上调整组织微环境。研究者观察到,小鼠表皮损伤后皮肤中的Treg促使KC发出急性促炎信号。使用单细胞测序方法,研究者确定了小鼠皮肤损伤时整合素αvβ8会在皮肤Treg上优先表达,Treg可以凭借该整合素激活潜伏的TGF-β,活化的TGF-β则可以直接作用于上皮细胞以促进趋化因子配体5的产生和中性粒细胞的募集。这一信号通路的激活抑制了小鼠表皮的再生,同时降低了金黄色葡萄球菌通过受损的皮肤屏障造成感染的概率。因此,皮肤中表达αvβ8的Treg与其典型的免疫抑制功能似乎存在矛盾,在皮肤屏障的完整性丧失后表现为促进炎症的急性发作,进而促进宿主对细菌感染的防御。张凡,编译自《Sci Immunol》, 2021,6(62):eabg2329;肖健,审校 -
参考文献
(37) [1] GalloRL,HooperLV.Epithelial antimicrobial defence of the skin and intestine[J].Nat Rev Immunol,2012,12(7):503-516.DOI: 10.1038/nri3228. [2] Cañedo-DorantesL,Cañedo-AyalaM.Skin acute wound healing: a comprehensive review[J].Int J Inflam,2019,2019:3706315.DOI: 10.1155/2019/3706315. [3] SorgH,TilkornDJ,HagerS,et al.Skin wound healing: an update on the current knowledge and concepts[J].Eur Surg Res,2017,58(1/2):81-94.DOI: 10.1159/000454919. [4] GrennanD.Diabetic foot ulcers[J].JAMA,2019,321(1):114.DOI: 10.1001/jama.2018.18323. [5] HanG,CeilleyR.Chronic wound healing: a review of current management and treatments[J].Adv Ther,2017,34(3):599-610.DOI: 10.1007/s12325-017-0478-y. [6] AlsterTS,TanziEL.Hypertrophic scars and keloids: etiology and management[J].Am J Clin Dermatol,2003,4(4):235-243.DOI: 10.2165/00128071-200304040-00003. [7] KischerCW,ThiesAC,ChvapilM.Perivascular myofibroblasts and microvascular occlusion in hypertrophic scars and keloids[J].Hum Pathol,1982,13(9):819-824.DOI: 10.1016/s0046-8177(82)80078-6. [8] BarrientosS,StojadinovicO,GolinkoMS,et al.Growth factors and cytokines in wound healing[J].Wound Repair Regen,2008,16(5):585-601.DOI: 10.1111/j.1524-475X.2008.00410.x. [9] AmiriN,GolinAP,JaliliRB,et al.Roles of cutaneous cell-cell communication in wound healing outcome: an emphasis on keratinocyte-fibroblast crosstalk[J].Exp Dermatol,2022,31(4):475-484.DOI: 10.1111/exd.14516. [10] HanCM,ChengB,WuP.Clinical guideline on topical growth factors for skin wounds[J/OL].Burns Trauma,2020,8:tkaa035[2022-02-15].https://pubmed.ncbi.nlm.nih.gov/33015207/.DOI: 10.1093/burnst/tkaa035. [11] ZubairM,AhmadJ.Role of growth factors and cytokines in diabetic foot ulcer healing: a detailed review[J].Rev Endocr Metab Disord,2019,20(2):207-217.DOI: 10.1007/s11154-019-09492-1. [12] WeiY,LiJ,HuangY,et al.The clinical effectiveness and safety of using epidermal growth factor, fibroblast growth factor and granulocyte-macrophage colony stimulating factor as therapeutics in acute skin wound healing: a systematic review and meta-analysis[J/OL].Burns Trauma,2022,10:tkac002[2022-02-15]. https://pubmed.ncbi.nlm.nih.gov/35265723/.DOI: 10.1093/burnst/tkac002. [13] ChenK,RaoZ,DongS,et al.Roles of the fibroblast growth factor signal transduction system in tissue injury repair[J/OL].Burns Trauma,2022,10:tkac005[2022-02-15]. https://pubmed.ncbi.nlm.nih.gov/35350443/.DOI: 10.1093/burnst/tkac005. [14] LiuY,LiuY,DengJ,et al.Fibroblast growth factor in diabetic foot ulcer: progress and therapeutic prospects[J].Front Endocrinol (Lausanne),2021,12:744868.DOI: 10.3389/fendo.2021.744868. [15] HuiQ,JinZ,LiX,et al.FGF family: from drug development to clinical application[J].Int J Mol Sci,2018,19(7):1875.DOI: 10.3390/ijms19071875. [16] KrookMA,ReeserJW,ErnstG,et al.Fibroblast growth factor receptors in cancer: genetic alterations, diagnostics, therapeutic targets and mechanisms of resistance[J].Br J Cancer,2021,124(5):880-892.DOI: 10.1038/s41416-020-01157-0. [17] TracyLE,MinasianRA,CatersonEJ.Extracellular matrix and dermal fibroblast function in the healing wound[J].Adv Wound Care (New Rochelle),2016,5(3):119-136.DOI: 10.1089/wound.2014.0561. [18] desJardins-ParkHE,FosterDS,LongakerMT.Fibroblasts and wound healing: an update[J].Regen Med,2018,13(5):491-495.DOI: 10.2217/rme-2018-0073. [19] DriskellRR,LichtenbergerBM,HosteE,et al.Distinct fibroblast lineages determine dermal architecture in skin development and repair[J].Nature,2013,504(7479):277-281.DOI: 10.1038/nature12783. [20] TabibT,MorseC,WangT,et al.SFRP2/DPP4 and FMO1/LSP1 define major fibroblast populations in human skin[J].J Invest Dermatol,2018,138(4):802-810.DOI: 10.1016/j.jid.2017.09.045. [21] ZhangZ,ShaoM,HeplerC,et al.Dermal adipose tissue has high plasticity and undergoes reversible dedifferentiation in mice[J].J Clin Invest,2019,129(12):5327-5342.DOI: 10.1172/JCI130239. [22] HaenselD,JinS,SunP,et al.Defining epidermal basal cell states during skin homeostasis and wound healing using single-cell transcriptomics[J].Cell Rep,2020,30(11):3932-3947.e6.DOI: 10.1016/j.celrep.2020.02.091. [23] Guerrero-JuarezCF,DedhiaPH,JinS,et al.Single-cell analysis reveals fibroblast heterogeneity and myeloid-derived adipocyte progenitors in murine skin wounds[J].Nat Commun,2019,10(1):650.DOI: 10.1038/s41467-018-08247-x. [24] ZhangLJ,ChenSX,Guerrero-JuarezCF,et al.Age-related loss of innate immune antimicrobial function of dermal fat is mediated by transforming growth factor beta[J].Immunity,2019,50(1):121-136.e5.DOI: 10.1016/j.immuni.2018.11.003. [25] ZhangX,LanY,XuJ,et al.CellMarker: a manually curated resource of cell markers in human and mouse[J].Nucleic Acids Res,2019,47(D1):D721-D728.DOI: 10.1093/nar/gky900. [26] JinS,Guerrero-JuarezCF,ZhangL,et al.Inference and analysis of cell-cell communication using CellChat[J].Nat Commun,2021,12(1):1088.DOI: 10.1038/s41467-021-21246-9. [27] MerrickD,SakersA,IrgebayZ,et al.Identification of a mesenchymal progenitor cell hierarchy in adipose tissue[J].Science,2019,364(6438):eaav2501.DOI: 10.1126/science.aav2501. [28] Berry-KilgourC,CabralJ,WiseL.Advancements in the delivery of growth factors and cytokines for the treatment of cutaneous wound indications[J].Adv Wound Care (New Rochelle),2021,10(11):596-622.DOI: 10.1089/wound.2020.1183. [29] YamakawaS,HayashidaK.Advances in surgical applications of growth factors for wound healing[J/OL].Burns Trauma,2019,7:10[2022-02-15].https://pubmed.ncbi.nlm.nih.gov/30993143/.DOI: 10.1186/s41038-019-0148-1. [30] MaddalunoL,UrwylerC,WernerS.Fibroblast growth factors: key players in regeneration and tissue repair[J].Development,2017,144(22):4047-4060.DOI: 10.1242/dev.152587. [31] XieY,SuN,YangJ,et al.FGF/FGFR signaling in health and disease[J].Signal Transduct Target Ther,2020,5(1):181.DOI: 10.1038/s41392-020-00222-7. [32] LindnerV,MajackRA,ReidyMA.Basic fibroblast growth factor stimulates endothelial regrowth and proliferation in denuded arteries[J].J Clin Invest,1990,85(6):2004-2008.DOI: 10.1172/JCI114665. [33] TaiAL,ShamJS,XieD,et al.Co-overexpression of fibroblast growth factor 3 and epidermal growth factor receptor is correlated with the development of nonsmall cell lung carcinoma[J].Cancer,2006,106(1):146-155.DOI: 10.1002/cncr.21581. [34] HuL,ShamJS,XieD,et al.Up-regulation of fibroblast growth factor 3 is associated with tumor metastasis and recurrence in human hepatocellular carcinoma[J].Cancer Lett,2007,252(1):36-42.DOI: 10.1016/j.canlet.2006.12.003. [35] YenTT,ThaoDT,ThuocTL.An overview on keratinocyte growth factor: from the molecular properties to clinical applications[J].Protein Pept Lett,2014,21(3):306-317.DOI: 10.2174/09298665113206660115. [36] WernerS,KriegT,SmolaH.Keratinocyte-fibroblast interactions in wound healing[J].J Invest Dermatol,2007,127(5):998-1008.DOI: 10.1038/sj.jid.5700786. [37] ZinkleA,MohammadiM.Structural bology of the FGF7 subfamily[J].Front Genet,2019,10:102.DOI: 10.3389/fgene.2019.00102. -
3 基于健康小鼠正常皮肤组织和全层皮肤缺损小鼠伤后7 d创面组织细胞单细胞RNA测序数据的、表达血小板衍生生长因子受体α基因的、真皮成纤维细胞亚群的特定基因表达情况气泡图
注:从左至右各列分别对应细胞群C0、C5、C7、C1、C2、C4、C17、C6、C13;左侧缩写与中文均为基因名称,DPP4为二肽基肽酶4,LY6A为淋巴细胞抗原6A,ICAM1为细胞间黏附分子1,CRAMP为组织蛋白酶抑制素,PLIN2为脂滴包被蛋白2,CXCL为C-X-C基序趋化因子,IL-4为白细胞介素4,VCAM1为血管细胞黏附分子1,PCNA为增殖细胞核抗原,SAA3为血清淀粉样蛋白A-3,LGR5为富含亮氨酸重复的G蛋白偶联受体5,CSF1R为集落刺激因子1受体,COLⅠα1为Ⅰ型胶原α1链蛋白,ENTPD1为外核苷三磷酸二磷酸水解酶1,LRIG1为亮氨酸丰富重复免疫球蛋白样域蛋白1,LEF1为淋巴增强子结合因子1,ALPL为肝肾骨碱性磷酸酶,ACTα2为肌动蛋白α2,TAGLN为肌动蛋白凝胶蛋白,MYL1为肌球蛋白轻链1,MYLPF为肌球蛋白可磷酸化调节轻链
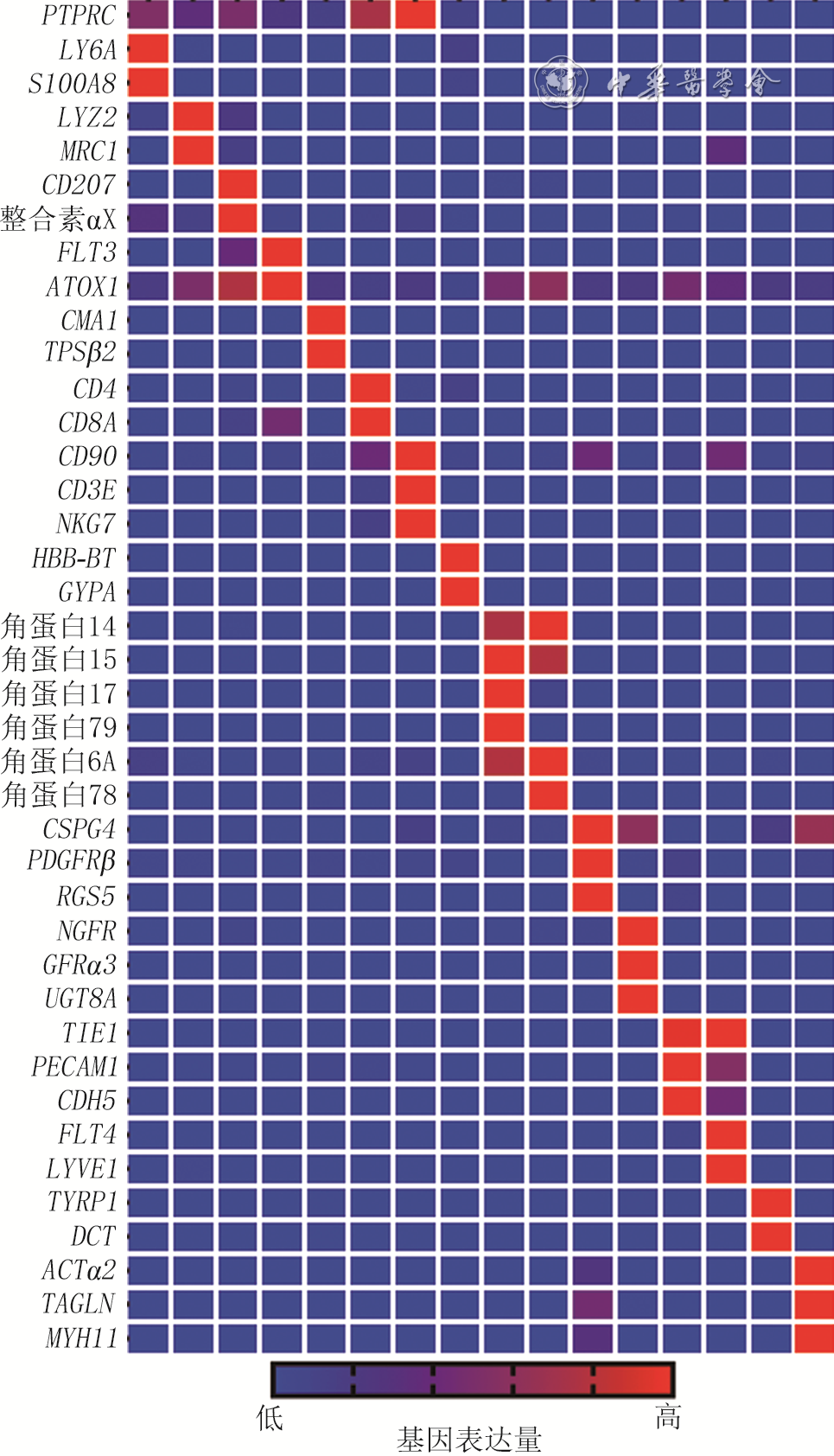
4 基于健康小鼠正常皮肤组织和全层皮肤缺损小鼠伤后7 d创面组织细胞单细胞RNA测序数据的、非真皮成纤维细胞群的特定基因表达情况热图
注:从左至右各列分别对应细胞群C3、C10、C12、C15、C22、C8、C20、C18、C9、C11、C14、C16、C19、C21、C23、C24;左侧缩写与中文均为基因名称,PTPRC为受体型蛋白酪氨酸磷酸酶C,LY6A为淋巴细胞抗原6A,S100A8为S100钙结合蛋白A8,MRC1为甘露糖受体C1,CMA1为糜蛋白酶1,TPSβ2为类胰蛋白酶β2,NKG为自然杀伤细胞相关蛋白,GYPA为血型糖蛋白A,CSPG4为硫酸软骨素蛋白聚糖4,PDGFRβ为血小板衍生生长因子受体β,RGS5为G蛋白信号通路调节蛋白5,NGFR为神经生长因子受体,GFRα3为胶质细胞源性神经营养因子家族受体α3,UGT8A为尿苷二磷酸糖基转移酶8A,TIE1为免疫球蛋白样表皮生长因子样域酪氨酸激酶1,PECAM1为血小板内皮细胞黏附分子1,LYVE1为淋巴管内皮透明质酸受体1,TYRP1为5,6-二羟基吲哚-2-羧酸氧化酶,DCT为多巴色素互变异构酶,ACTα2为肌动蛋白α2,TAGLN为肌动蛋白凝胶蛋白,MYH11为肌球蛋白轻链11
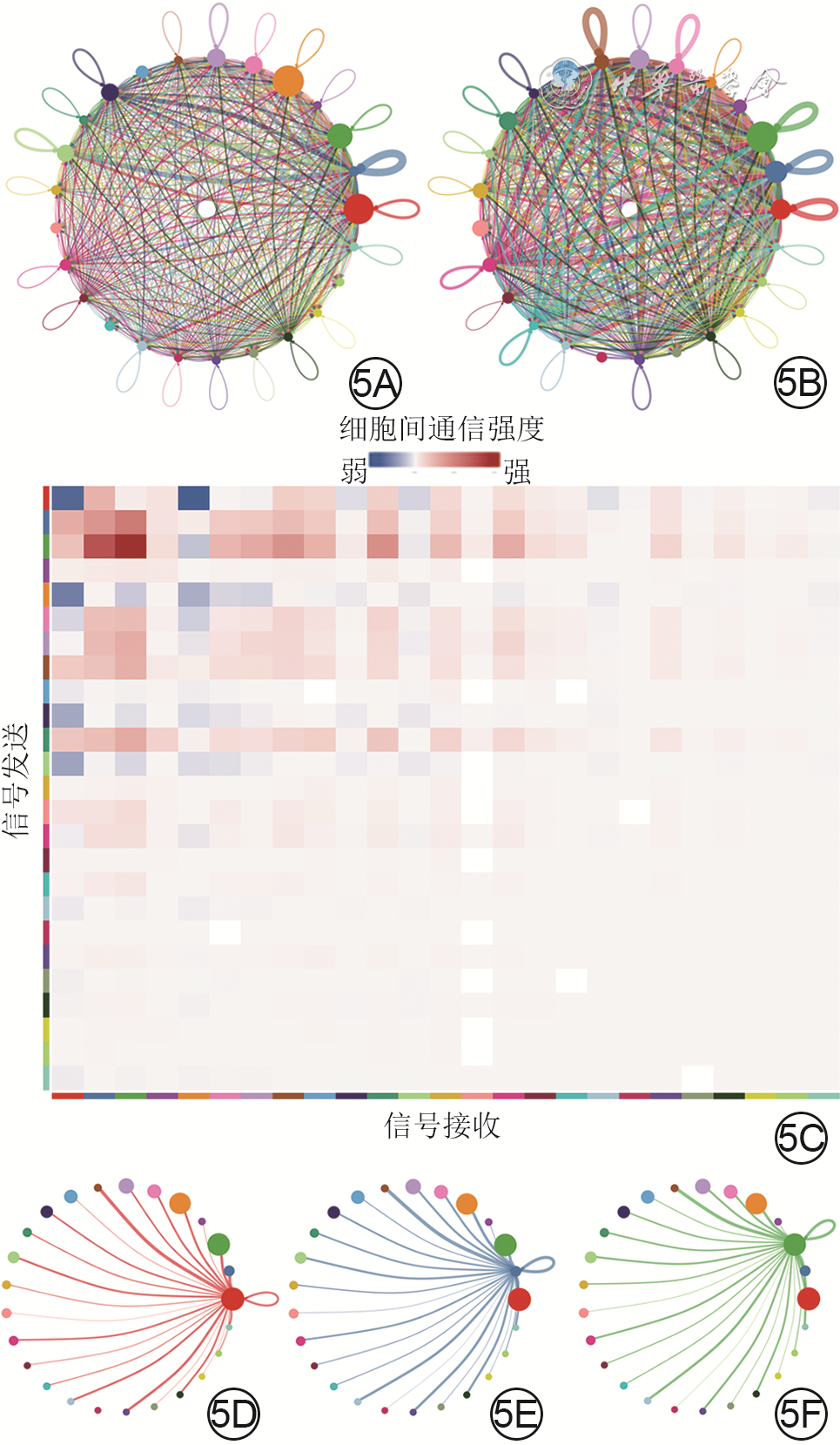
5 基于健康小鼠正常皮肤组织和全层皮肤缺损小鼠伤后7 d创面组织细胞单细胞RNA测序数据的细胞间通信网络图与热图。5A、5B.分别为正常皮肤组织、创面组织中细胞间通信情况网络图,图5B中细胞间通信较图5A更多更密集;5C.创面组织中细胞间通信强度热图;5D、5E、5F.分别为创面组织中细胞群C0、C1、C2与其他细胞群通信情况网络图
注:图5A、5B、5D、5E、5F中从最右侧红点开始,逆时针排列的25个点代表25个细胞群,对应编号为C0~C24,图中连线代表细胞间通信,连线的颜色与信号发送细胞群颜色一致,连线的粗细代表信号强度,点大小代表细胞群中细胞量;图5C中从左侧顶部/底部最左侧红色块开始,向下/右排列的25个色块代表25个细胞群,对应编号为C0~C24
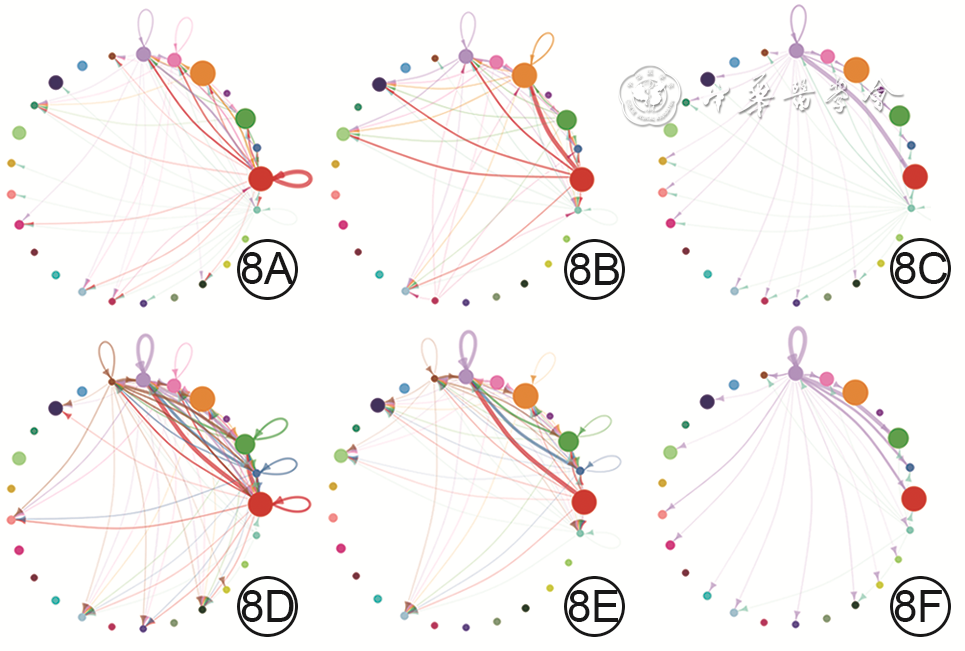
8 基于健康小鼠正常皮肤组织和全层皮肤缺损小鼠伤后7 d创面组织细胞单细胞RNA测序数据的、成纤维细胞生长因子(FGF)的各亚型与FGF受体(FGFR)各亚型的两两配对信号通路中的细胞间通信网络图。8A、8B、8C.分别为正常皮肤组织中FGF7-FGFR1、FGF7-FGFR2、FGF10-FGFR1信号通路中的细胞间通信,图8A中的细胞间通信较少,图8B中的细胞间通信较多,图8C中的细胞间通信少;8D、8E、8F.分别为创面组织中FGF7-FGFR1、FGF7-FGFR2、FGF10-FGFR1信号通路中的细胞间通信,图8D中细胞间通信明显多于图8A,图8E中细胞间通信稍少于图8B,图8F中细胞间通信与图8C相近,图8E、8F中细胞间通信明显少于图8D
注:网络图中从最右侧红点开始,逆时针排列的25个点代表25个细胞群,对应编号为C0~C24;网络图中连线代表细胞间通信,连线的颜色与信号发送细胞群颜色一致,连线的粗细代表信号强度,点大小代表细胞群中细胞量
9 健康小鼠正常皮肤组织和全层皮肤缺损小鼠伤后7 d创面组织中FGF7蛋白表达与分布及其与DPP4、SCA1、SMA、PDGFRα蛋白的共定位表达 花青素3-异硫氰酸荧光素-花青素5-4',6-二脒基-2-苯基吲哚×200,图中标尺为2 mm。9A、9B、9C、9D与9E、9F、9G、9H.分别为正常皮肤组织与创面组织中FGF7染色、DPP4染色、SCA1染色、FGF7与DPP4和SCA1及细胞核染色的重叠图片,图9A中FGF7蛋白表达量少,主要位于皮肤间质层且在靠近真皮白色脂肪组织附近也有表达,图9B中DPP4蛋白表达较多,图9C中SCA1蛋白表达较多,图9D中FGF7与DPP4和SCA1的蛋白共定位表达较少,图9E中FGF7蛋白表达量明显多于图9A,图9F中DPP4蛋白表达量与图9B相近,图9G中SCA1蛋白表达量与图9C相近,图9H中FGF7与DPP4和SCA1的蛋白共定位表达明显多于图9D;9I、9J、9K、9L与9M、9N、9O、9P.分别为正常皮肤组织与创面组织中FGF7染色、SMA染色、PDGFRα染色、FGF7与SMA和PDGFRα及细胞核染色的重叠图片,图9I中FGF7蛋白表达部位与图9A相近但量较少,图9J中SMA蛋白表达量少,图9K中PDGFRα蛋白表达量较少,图9L中FGF7蛋白与SMA蛋白无共定位且和PDGFRα蛋白的共定位表达少,图9M中FGF7蛋白表达量明显多于图9I,图9N中SMA蛋白表达明显多于图9J,图9O中PDGFRα蛋白表达与图9K相近,图9P中FGF7蛋白与SMA蛋白无共定位且与PDGFRα蛋白的共定位表达明显多于图9L
注:成纤维细胞生长因子7(FGF7)阳性染色为红色,二肽基肽酶4(DPP4)与平滑肌肌动蛋白(SMA)阳性染色均为绿色,干细胞抗原1 (SCA1)与血小板衍生生长因子受体α(PDGFRα)阳性染色均为蓝紫色,细胞核染色为白色;绿色箭头指示FGF7蛋白在间质层的分布,黄色箭头指示FGF7蛋白在白色脂肪组织附近的分布,红色箭头指示FGF7蛋白与其他蛋白共定位位置
-









 下载:
下载: